
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 14. Химическая идентификация
|
|
|
|
Для получения синтетических каучуков в качестве мономеров не используется
| а) 1,3-бутадиен | в) стирол |
| б) 2-хлор-1,3-бутадиен | г) формальдегид |
13-125. Натуральный каучук представляет собой полимер, мономером которого является
| а) пропен | в) дивинил |
| б) стирол | г) изопрен |
13-126. Разрушение полимеров под воздействием физико-химических факторов называется
| а) девулканизация | в) десорбция |
| б) деструкция | г) дестабилизация |
13-127. К гетерополимерам относится
| а) нейлон | в) тефлон |
| б) поливинилхлорид | г) каучук |
13-128. К гомополимерам относится
| а) лавсан | в) нейлон |
| б) полиэтиленадипинат | г) тефлон |
13-129. Процесс образования дисульфидных мостиков в структуре каучука называется
| а) вулканизацией | в) полимеризацией |
| б) деформацией | г) поликонденсацией |
13-130. При изменении линейной структуры полимеров на сетчатую происходит уменьшение
| а) прочности | в) степени полимеризации |
| б) эластичности | г) стереорегулярности |
13-131. К природным полимерам относятся
| а) нуклеиновые кислоты | в) витамины |
| б) эпоксидные смолы | г) гормоны |
13-132. Белок, который осуществляет перенос кислорода из легких к органам и тканям человека и животных, называется
| а) инсулин | в) альбумин |
| б) гемоглобин | г) протеин |
13-133. Глюкоза образуется при кислотном гидролизе
| а) пектиновых веществ | в) целлюлозы |
| б) инсулина | г) хитина |
14-1. Определение элементов в соединениях или соединений в смесях – это задача
| а) количественного анализа | г) объёмного анализа |
| б) качественного анализа | д) предварительного анализа |
| в) фазового анализа |
14-2. Определение относительных количеств элементов в соединениях и соединений в смесях – это задача
| а) количественного анализа | г) объёмного анализа |
| б) качественного анализа | д) предварительного анализа |
| в) фазового анализа |
14-3. Водородный показатель pH раствора рассчитывается по формуле
| а) pH = –lgCH+ | б) pH = –lnCH+ | в) pH = –CH+ | г) pH = –eCH+ |
14-4. Химическая идентификация и анализ веществ являются предметом ___ химии.
| а) аналитической | в) органической |
| б) физической | г) неорганической |
14-5. Гравиметрический или весовой анализ – это один из методов
| а) физико-химического анализа | в) физического анализа |
| б) химического анализа | г) потенциометрического анализа |
14-6. Момент, когда количество добавляемого вещества эквивалентно количеству определяемого вещества, называется
а) точкой эквивалентности
б) точкой титрования
в) точкой изменения окраски индикатора
г) точкой изменения электропроводности
14-7. Интенсивность электромагнитного излучения пробы отражает
а) специфические свойства вещества
б) количество анализируемого вещества
в) структуру вещества
г) pH анализируемого вещества
14-8. Атомная спектроскопия относится к
а) химическим
б) физико-химическим
в) физическим методам анализа
г) к анализу органических соединений
д) потенциометрическим методам анализа
14-9. Сравнение интенсивности окраски исследуемого раствора с окраской стандартного раствора проводится при ___ методе анализа.
| а) потенциометрическом | в) хроматографическом |
| б) колориметрическом | г) весовом |
14-10. Метод, основанный на измерении величины электродных потенциалов, зависящих от концентрации раствора, называется ___ методом анализа
| а) полярографическим | в) кондуктометрическим |
| б) потенциометрическим | г) хроматографическим |
14-11. Соответствие между методами анализа и основными характеристиками вещества
| 1) | гравиметрический | а) | осадок определённой массы |
| 2) | объемный газовый анализ | б) | количество газа |
| 3) | кондуктометрия | в) | измерение электропроводности раствора |
| 4) | потенциометрия | г) | измерение ЭДС элементов |
| д) | избирательная адсорбция вещества |
14-12. Последовательность любого анализа
| а) отбор пробы | в) сравнение с этанолом |
| б) выбор метода анализа | г) установление требуемого параметра |
14-13. Согласно закону Ламберта – Бера: интенсивность поглощённого раствором света пропорциональна
| а) концентрации вещества | в) давлению |
| б) температуре | г) молярной массе вещества |
14-14. Соответствие основных методов количественного анализа и измеряемой величины следующее
| 1) | гравиметрический метод | а) | масса вещества |
| 2) | кулонометрия | б) | количество электричества |
| 3) | вискозиметрический метод | в) | вязкость |
| 4) | криоскопия | г) | понижение температуры замерзания |
| д) | объем |
14-15. Окислитель – это частица, которая ___ электроны.
| а) принимает | в) сортирует |
| б) отдает | г) разделяет |
14-16. Разделение веществ, обладающих различной адсорбционной способностью, проводят с помощью метода анализа, называемого
| а) хроматографией | в) полярографией |
| б) потенциометрией | г) кулонометрией |
14-17. Методы анализа, основанные на изучении спектров излучения, называются ___ методами.
| а) спектральными | в) полярографическими |
| б) потенциометрическими | г) кулонометрическими |
14-18. Формулой 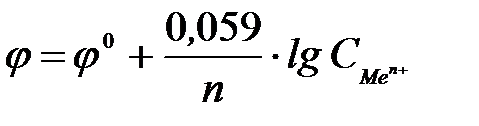 описывается зависимость электродного потенциала φ от ___ С.
описывается зависимость электродного потенциала φ от ___ С.
| а) концентрации | в) температуры |
| б) скорости | г) вязкости |
14-19. 10 мл раствора щелочи концентрацией 1 моль/л нейтрализовали 5 мл кислоты. Концентрация кислоты ___ моль/л.
14-20. Предел обнаружения вещества при предельной концентрации 10–7 моль/л и объеме раствора 20 мл равен ___ мкг.
14-21. Электродный потенциал медного электрода в растворе с концентрацией 1 моль/л равен ___ вольт. (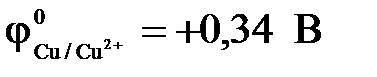 ).
).
14-22. Осаждение определенного компонента в виде малорастворимого соединения относится к методу анализа
| а) весовому | в) осадительному титрованию |
| б) титриметрическому | г) выделительному |
14-23. Образование осадков определенного цвета относится к методам анализа
| а) химическим | в) физическим |
| б) физико-химическим | г) анализу органических веществ |
14-24. Метод определения концентрации раствора при измерении его электропроводности называется
| а) хроматографическим | г) потенциометрическим |
| б) кондуктометрическим | д) кулонометрическим |
| в) колориметрическим |
14-25. Метод анализа, при котором происходит постепенное прибавление одного раствора с известной концентрацией к другому раствору, концентрацию которого нужно определить, называется
| а) хроматографическим | г) потенциометрическим |
| б) кондуктометрическим | д) гравиметрическим |
| в) титриметрическим |
14-26. Оптическая молекулярная спектроскопия относится к методам анализа
| а) химическим | г) анализу органических веществ |
| б) физико-химическим | д) потенциометрическим |
| в) физическим |
14-27. На избирательной адсорбции различных веществ некоторыми твердыми материалами основан метод анализа, называемый
| а) хроматографическим | г) потенциометрическим |
| б) кондуктометрическим | д) гравиметрическим |
| в) титриметрическим |
14-28. Соответствие между определяемым ионом и реактивом на него
| а) SO42- | 1) HCl |
| б) Cl- | 2) BaCl2 |
| в) CO32- | 3) AgNO3 |
| г) NH4+ | 4) NaOH |
14-29. Соответствие между определяемым ионом и реактивом на него
| а) Fe2+ | 1) HCl |
| б) Na+ | 2) H2SO4 |
| в) Ba2+ | 3) K3[Fe(CN)6] |
| г) Ag+ | 4) окраска пламени |
14-30. Водородный показатель рН раствора HCl с концентрацией 0,001 моль/л равен ___.
*_ _*_ _*_
14-31. При взаимодействии ионов Fe3+ с гексацианоферратом (II) калия наблюдается образование
| а) темно-синего осадка | в) кроваво-красного раствора |
| б) бурого осадка | г) белого осадка |
14-32. Присутствие иона Cu2+ в смеси с ионами Fe2+, Fe3+, Zn2+ можно доказать, используя в качестве реактива
| а) раствор K4[Fe(CN)6] | в) раствор K3[Fe(CN)6] |
| б) раствор H2S | г) раствор аммиака |
14-33. При обнаружении сульфат-иона раствором соли бария наблюдается образование
| а) бурого осадка | в) белого осадка |
| б) бурого раствора | г) белого раствора |
14-34. При взаимодействии ионов Cu2+ c избытком раствора аммиака наблюдается образование
| а) кроваво-красного раствора | в) ярко-синего раствора |
| б) белого осадка | г) красного осадка |
14-35. Формула реагента, используемого для качественного определения
хлорид-ионов в растворе, имеет вид
| а) AgI | б) AgNO3 | в) Ag2S | г) Ag3PO4 |
14-36. При действии сероводорода на раствор, содержащий ионы Cu2+, наблюдается образование
| а) черного осадка | в) синего раствора |
| б) красного раствора | г) синего осадка |
14-37. При действии на раствор, содержащий ионы Fe2+, раствора красной кровяной соли, наблюдается образование
| а) бурого раствора | в) темно-синего осадка |
| б) кроваво-красного раствора | г) бурого осадка |
14-38. При взаимодействии иона Fe3+ с роданидом калия наблюдается образование
| а) темно-синего раствора | в) кроваво-красного раствора |
| б) бурого осадка | г) темно-синего раствора |
14-39. Признаком протекания качественной реакции между йодом и крахмалом является
| а) образование бурой окраски | в) образование синей окраски |
| б) выпадение бурого осадка | г) выделение бурого газа |
14-40. Для качественного определения карбонат-иона используется раствор
| а) сильной кислоты | в) средней соли |
| б) сильного основания | г) органического индикатора |
14-41. Ионы калия окрашивают пламя в ____ цвет.
| а) зеленый | б) красный | в) желтый | г) фиолетовый |
14-42. Ионы натрия окрашивают пламя в ____ цвет.
| а) зеленый | б) красный | в) желтый | г) фиолетовый |
14-43. Формула реагента, используемого для качественного определения ионов аммония в растворе, имеет вид
| а) BaCl2 | б) NaOH | в) H2SO4 | г) Fe(OH)2 |
14-44. Для обнаружения ионов Cu2+ в растворе можно использовать раствор
| а) сульфата аммония | в) хлорида аммония |
| б) нитрата аммония | г) аммиака |
14-45. Реагентом на ионы Fe3+ является вещество, формула которого
| а) NH4Cl | б) K2SO4 | в) Cu(OH)2 | г) NH4CNS |
14-46. Методы анализа, основанные на способности вещества поглощать свет определенной длины волны, называются
| а) радиометрическими | в) спектрофотометрическими |
| б) потенциометрическими | г) фотоэмиссионными |
14-47. Величина, показывающая отношение суммарной концентрации всех форм вещества в органической фазе, к суммарной концентрации всех форм вещества в водной фазе, называется коэффициентом
| а) отделения | в) удаления |
| б) распределения | г) выделения |
14-48. В основе потенциометрического метода анализа лежит уравнение ___.
| а) Нернста | в) Ламберта –Бугера – Бера |
| б) Гиббса | г) Фарадея |
14-49. Индикационным параметром для установления качественного состава веществ спектральными методами является
| а) сила тока | в) интенсивность линии |
| б) длина волны | г) оптическая плотность |
14-50. Величина, которая является качественной характеристикой вещества и зависит от его природы, в методе спектрофотометрии называется
| а) амплитудой сигнала | в) длиной волны |
| б) оптической плотностью | г) интенсивностью поглощения |
14-51. Для определения рН растворов потенциометрическим методом наиболее часто используется ____ электрод.
| а) газовый | в) окислительно-восстановительный |
| б) металлический | г) стеклянный |
14-52. Величина, зависящая от концентрации анализируемого вещества в методе спектрофотометрии, называется
| а) интенсивность окраски | в) оптическая плотность |
| б) интенсивность излучения | г) длина волны |
14-53. Метод анализа, основанный на зависимости потенциала электрода от концентрации ионов, называется
| а) кулонометрия | в) кондуктометрия |
| б) потенциометрия | г) полярография |
14-54. Реагент, который можно использовать для качественного определения сульфат-ионов в растворе, имеет название
| а) нитрат аммония | в) нитрат натрия |
| б) нитрат бария | г) нитрат калия |
14-55. Ядерно-химические методы анализа основаны на самопроизвольном распаде ядер некоторых изотопов, который называется
| а) люминисцентным | в) радиоактивным |
| б) фотометрическим | г) электрохимическим |
14-56. Световой поток при прохождении через коллоидный раствор подвергается
| а) интерференции | в) дифракционному рассеиванию |
| б) флуоресценции | г) адсорбции |
14-57. Хроматографические методы анализа основаны на различной ____ способности определяемых веществ.
| а) сорбционной | в) электрохимической |
| б) фотохимической | г) окислительно-восстановительной |
14-58. Интенсивность излучения при прохождении через образец в методе атомно-адсорбционной спектроскопии
| а) не изменяется | в) увеличивается |
| б) уменьшается | г) изменяется неоднозначно |
14-59. Различная способность веществ к адсорбции используется в
| а) рентгенографии | в) хроматографии |
| б) томографии | г) полярографии |
14-60. Метод анализа, основанный на точном измерении массы определяемого вещества или его составных частей, выделяемых в виде соединений постоянного состава, называется
| а) гравиметрическим | б) колориметрическим |
| в) физическим | г) титриметрическим |
14-61. Свечение атомов, молекул или других частиц, возникающее при электронных переходах из возбужденного состояния в основное, называется
| а) фотометрией | в) релаксацией |
| б) эмиссией | г) люминисценцией |
14-62. Метод анализа, основанный на зависимости электропроводности раствора от концентрации электролита, называется
| а) кондуктометрией | в) кулонометрией |
| б) полярографией | г) потенциометрией |
14-63. Метод разделения, основанный на проникновении молекул и ионов через мембрану, непроницаемую для коллоидных частиц, называется
| а) переносом | б) электрофорезом | в) диализом | г) осмосом |
14-64. Вещество, на поверхности которого происходит разделение и концентрирование анализируемых веществ в методе хроматографии, называется
| а) сорбент | б) сорбтив | в) сорбат | г) элюент |
14-65. Промежуток времени, в течение которого происходит распад половины радиоактивных ядер элемента, называется
| а) периодом полураспада | в) временем распада |
| б) периодом разложения | г) характеристическим временем |
14-66. Метод анализа, основанный на зависимости массы преобразованного вещества от количества электричества, называется
| а) полярографией | в) кондуктометрией |
| б) потенциометрией | г) кулонометрией |
14-67. Метод количественного анализа, основанный на измерении количества реагента, затрачиваемого на реакцию с определяемым веществом, называется
| а) физическим | в) гравиметрическим |
| б) титриметрическим | г) колориметрическим |
14-68. Наиболее удобным способом перевода вещества в атомарное состояние является
| а) пламя | б) свет |
| б) механическое воздействие | г) радиочастота |
14-69. Метод кулонометрии основан на использовании закона
| 1) Клапейрона – Клаузиса | 3) Фарадея |
| 2) Эйнштейна | 4) Ламберта – Бугера – Бера |
14-70. Одним из наиболее часто используемых методов перевода вещества в атомарное состояния является
| 1) ультразвук | 3) пламя |
| 2) механическое воздействие | 4) радиочастота |
14-71. Массу вещества, выделившегося или разложившегося в результате электролиза, можно вычислить, используя закон
| 1) Фарадея | 3) Вант-Гоффа |
| 2) Аррениуса | 4) Гесса |
14-72. Атомно-эмиссионные методы анализа основаны на способности возбужденных атомов вещества ____ электромагнитное излучение.
| 1) преломлять | 3) отклонять |
| 2) испускать | 4) поглощать |
14-73. Величина, которая является качественной характеристикой вещества и зависит от его природы в методе спектрофотометрии, называется
| а) длиной волны | в) разностью потенциалов |
| б) световым потоком | г) амплитудой сигнала |
14-74. Для определения рН растворов потенциометрическим методом в качестве индикаторного наиболее часто используется ___ электрод.
| а) металлический | в) каломельный |
| б) стеклянный | г) газовый |
14-75. Раствор, в 500 мл которого растворено 1,825 г HCl, имеет рН, равный
| а) 1 | б) 5 | в) 2 | г) 4 |
14-76. В 2 л раствора гидроксида калия, имеющего рН 13, содержится ___ моль КОН.
| а) 0,1 | б) 2 | в) 1 | г) 0,2 |
14-77. В 1 л раствора азотной кислоты, имеющего рН 1, содержится ___ моль кислоты.
| а) 0,2 | б) 1 | в) 10 | г) 0,1 |
14-78. В 2 л раствора азотной кислоты, имеющего рН 2, содержится ___ моль HNO3.
| а) 0,02 | б) 1 | в) 0,01 | г) 2 |
14-79. В 1 литре раствора NaOH, имеющего рН 13, содержится ___ моль гидроксида.
| а) 0,1 | б) 0,26 | в) 0,2 | г) 0,13 |
14-80. При разбавлении 0,2М раствора соляной кислоты в два раза рН будет иметь значение
| а) 3 | б) 4 | в) 1 | г) 14 |
14-81. В 400 мл 0,2М раствора нитрата натрия содержится ___ г соли.
| а) 34 | б) 13,6 | в) 6,8 | г) 68 |
14-82. Объем 0,1н раствора КОН, необходимый для нейтрализации 20 мл 0,15н раствора азотной кислоты, равен
| а) 15 мл | б) 45 мл | в) 30 мл | г) 20 мл |
14-83. При титровании раствора, содержащего 0,1 г вещества, израсходовано 21,5 мл 0,1 н раствора HCI. Массовая доля гидроксида натрия в образце равна
| а) 86% | б) 76% | в) 96% | г) 100% |
14-84. Объем 0,1М раствора хлорида кальция, необходимый для осаждения карбонат-ионов из 200 мл 0,15М раствора карбоната калия, равен ___ мл.
| а) 100 | б) 150 | в) 300 | г) 200 |
14-85. Объем 0,2н раствора серной кислоты, необходимый для нейтрализации 40 мл 0,15н раствора гидроксида натрия, равен
| а) 53 мл | б) 60 мл | в) 45 мл | г) 30 мл |
14-86. Для нейтрализации 200 мл 0,1М раствора серной кислоты требуется ___ мл 0,2М раствора гидроксида натрия.
| а) 400 | б) 50 | в) 200 | г) 100 |
14-87. Объем 0,1М раствора нитрата бария, необходимый для осаждения сульфат-ионов из 100 мл 0,2М раствора серной кислоты,
| а) 50 | б) 150 | в) 100 | г) 200 |
14-88. Масса осадка, образующегося при смешении 100 мл 0,1М раствора FeCl3 и 150 мл 0,2М раствора NaOH, равна ___ граммов.
| а) 2,14 | б) 3,21 | в) 1,07 | г) 4,28 |
14-89. Масса осадка, образующегося при сливании 200 мл 0,1М раствора карбоната натрия и 100 мл 0,15 моль раствора хлорида кальция, равна ____ граммов.
| а) 3,0 | б) 1,5 | в) 2,0 | г) 4,0 |
14-90. Для осаждения хлорид-ионов из 200 мл 0,1М раствора соляной кислоты требуется раствор, содержащий ___ граммов нитрата серебра.
| а) 1,7 | б) 3,4 | в) 5,1 | г) 0,85 |
14-91. Масса осадка, образующегося при сливании 50 мл 0,2М раствора нитрата серебра и 100 мл 0,1М раствора хлорида натрия, равна
| а) 2,88 г | б) 0,72 г | в) 1,44 г | г) 2,16 г |
14-92. Объем 0,5М раствора соляной кислоты, необходимый для нейтрализации 50 мл 0,2М раствора гидроксида бария, равен
| а) 30 мл | б) 10 мл | в) 20 мл | г) 40 мл |
14-93. Масса уксусной кислоты, содержащейся в растворе, на нейтрализацию которого израсходовано 250 мл 0,2 М раствора гидроксида натрия, составляет ___ граммов.
| а) 3,0 | б) 6,0 | в) 1,5 | г) 4,5 |
14-94. Количество азотной кислоты, содержащейся в растворе, на нейтрализацию которого израсходовано 100 мл 0,2М раствора NaOH, составляет ____ моль.
| а) 0,01 | б) 0,02 | в) 0,1 | г) 0,2 |
14-95. Объем 0,15н раствора серной кислоты, необходимый для осаждения
ионов бария из 60 мл 0,2н раствора хлорида бария, равен
| а) 80 мл | б) 90 мл | в) 180 мл | г) 40 мл |
14-96. Раствор гидроксида бария имеет рН = 12. Концентрация основания в растворе при 100 % диссоциации равна ____ моль/л.
| а) 0,001 | б) 0,005 | в) 0,1 | г) 0,01 |
14-97. Объем раствора серной кислоты с молярной концентрацией эквивалента 0,2 моль/л, необходимый для нейтрализации 40 мл раствора гидроксида натрия с молярной концентрацией эквивалента 0,15 моль/л, равен ___ миллилитрам.
| а) 53 | б) 60 | в) 45 | г) 30 |
14-98. Объем раствора серной кислоты с молярной концентрацией эквивалентна 0,15 моль/л, необходимый для осаждения ионов бария из 60 мл раствора хлорида бария с молярной концентрацией эквивалента 0,2 моль/л, равен ___ миллилитрам.
| а) 40 | б) 180 | в) 80 | г) 90 |
14-99. Раствор соляной кислоты имеет рН = 2. Концентрация кислоты в растворе при 100 % диссоциации равна ____ моль/л.
| а) 0,01 | б) 0,001 | в) 0,05 | г) 0,05 |
14-100. Раствор азотной кислоты имеет рН = 2. Концентрация азотной кислоты в растворе при 100 % диссоциации равна ____ моль/л.
| а) 0,05 | б) 0,001 | в) 0,01 | г) 0,1 |
14-101. Раствор гидроксида калия имеет рН = 12. Концентрация основания в растворе при 100 % диссоциации равна ____ моль/л.
| а) 0,01 | б) 0,001 | в) 0,005 | г) 0,1 |
14-102. Раствор гидроксида бария имеет рН=13. Концентрация основания в растворе при 100 % диссоциации равна ___ соль/л.
| а) 0,005 | б) 0,001 | в) 0,05 | г) 0,1 |
14-103. Объем раствора KOH с молярной концентрацией эквивалента 0,1 моль/л, необходимый для нейтрализации 20 мл раствора азотной кислоты с молярной концентрацией эквивалента 0,15 моль/л, равен ___ миллилитрам.
| а) 15 | б) 60 | в) 45 | г) 30 |
14-104. Для нейтрализации 100 мл раствора серной кислоты с молярной концентрацией 0,1 моль/л требуется ___ мл раствора гидроксида калия с молярной концентрацией 0,2 моль/л.
| а) 150 | б) 300 | в) 50 | г) 100 |
14-105. Для осаждения хлорид-ионов из 100 мл раствора соляной кислоты с молярной концентрацией 0,1 моль/л требуется раствор, содержащий ___ грамма нитрата серебра.
| а) 10,2 | б) 6,8 | в) 5,1 | г) 1,7 |
14-106. Раствор азотной кислоты имеет рН = 1. Концентрация кислоты в растворе при 100 % диссоциации равна ___ моль/л.
| а) 0,001 | б) 0,01 | в) 0,1 | г) 0,005 |
14-107. В 1 л раствора азотной кислоты, имеющего рН 2, содержится ___ моль HNO3.
| а) 0,01 | б) 0,02 | в) 1 | г) 0,5 |
14-108. Раствор серной кислоты имеет рН = 1. Концентрация кислоты в растворе при 100 % диссоциации равна ___ моль/л.
| а) 0,05 | б) 0,001 | в) 0,5 | г) 0,01 |
14-109. Раствор бромоводородной кислоты имеет рН = 1. Концентрация кислоты в растворе при 100% диссоциации равна ___ моль/л.
| а) 0,5 | б) 0,001 | в) 0,1 | г) 0,01 |
14-110. Для нейтрализации 100 мл раствора азотной кислоты с молярной концентрацией 0,2 моль/л необходим раствор, содержащий ____ грамма(ов) гидроксида натрия.
| а) 0,4 | б) 4 | в) 0,8 | г) 8 |
14-111. Объем раствора соляной кислоты с молярной концентрацией 0,5 моль/л, необходимый для нейтрализации 50 мл раствора гидроксида натрия с молярной концентрацией 0,2 моль/л, равен ___ миллилитрам.
| а) 30 | б) 10 | в) 40 | г) 20 |
14-112. Для нейтрализации 150 мл раствора гидроксида калия с молярной концентрацией 0,2 моль/л требуется раствор, содержащий ___ грамма(ов) уксусной кислоты.
| а) 3,6 | б) 1,8 | в) 5,0 | г) 6,0 |
14-113. Для нейтрализации 40 мл раствора уксусной кислоты с молярной концентрацией 0,5 моль/л требуется раствор, содержащий ___ моль гидроксида натрия.
| а) 0,02 | б) 0,01 | в) 0,04 | г) 0,05 |
14-114. Количество азотной кислоты, содержащееся в растворе, на нейтрализацию которого израсходовано 100 мл раствора NaOH с молярной концентрацией 0,2 моль/л, составляет ___ моль.
| а) 0,01 | б) 0,02 | в) 0,1 | г) 0,2 |
14-115. Масса осадка, образующегося при взаимодействии 100 мл раствора FeCl3 с молярной концентрацией 0,1 моль/л с избытком раствора NaOH, равна ___ грамма.
| а) 1,07 | б) 8,64 | в) 6,42 | г) 5,35 |
14-116. Масса HNO3, необходимая для взаимодействия с раствором NaOH объемом 70 мл и концентрацией щелочи 0,5 моль /л, составляет ___ грамма.
| а) 2,2 | б) 6,3 | в) 0,35 | г) 0,5 |
14-117. Для приготовления 2 л раствора соляной кислоты с рН = 1 требуется моль HCl.
| а) 0,1 | б) 2,0 | в) 0,2 | г) 1,0 |
14-118. Раствор, в 1 л которого содержится 0,01 моль азотной кислоты, имеет рН, равный
| а)12 | б)11 | в) 4 | г) 2 |
14-119. Для приготовления 1 л раствора гидроксида калия с рН 12 необходимо ___ моль KOH.
| а) 0,02 | б) 2 | в) 1 | г) 0,01 |
14-120. Масса уксусной кислоты, содержащейся в растворе, на нейтрализацию которого израсходовано 250 мл раствора гидроксида натрия с молярной концентрацией 0,2 моль/л, составляет ___ грамма(ов).
| а) 3,0 | б) 6,0 | в) 1,5 | г) 7,5 |
14-121. Масса HNO3, необходимая для взаимодействия с раствором NaOH объемом 70 мл и концентрацией щелочи 0,5 моль/л, составляет ___ грамма.
| а) 0,35 | б) 6,3 | в) 0,5 | г) 2,2 |
14-122. В 1 л раствора гидроксида калия, имеющего рН 13, содержится ___ моль KOH.
| а) 1 | б) 0,1 | в) 0,5 | г) 0,2 |
14-123. Раствор гидроксида натрия имеет рН = 13. Концентрация основания в растворе при 100% диссоциации равна ___ моль/л.
| а) 0,1 | б) 0,01 | в) 0,005 | г) 0,001 |
14-124. Раствор гидроксида натрия имеет рН = 12. Концентрация основания в растворе при 100% диссоциации равна ___ моль/л.
| а) 0,1 | б) 0,01 | в) 0,005 | г) 0,001 |
14-125. Ионы Ba2+ в растворе можно обнаружить с помощью реагента, формула которого
| а) H2S | б) H2SO4 | в) HNO3 | г) CH3COOH |
14-126. Вещество, изменяющее свою окраску в зависимости от рН среды, называется
| а) реагентом | в) индикатором |
| б) электролитом | г) красителем |
14-127. Метод количественного анализа, основанный на измерении количества реагента, затраченного на реакцию с определяемым веществом, называется
| а) гравиметрическим | в) титриметрическим |
| б) колориметрическим | г) физическим |
14-128. Атомно-эмиссионные методы анализа основаны на способности возбужденных атомов вещества ___ электромагнитное излучение.
| а) отклонять | в) поглощать |
| б) испускать | г) преломлять |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1389; Нарушение авторских прав?; Мы поможем в написании вашей работы!