
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 11. Электрохимические процессы. Гальванический элемент. Коррозия металлов 2 страница
|
|
|
|
| а) больше | в) равна |
| б) меньше | г) ЭДС отсутствует |
11-63. ЭДС гальванического элемента Fe | Fe2+ || Cu2+ | Cu в сравнении с ЭДС элемента Fe | Fe2+ || Ag+ | Ag
(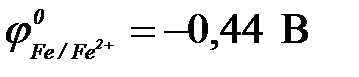 ,
,  ,
, 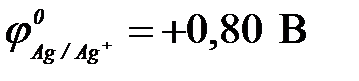 )
)
| а) больше | в) равна |
| б) меньше | г) ЭДС отсутствует |
11-64. ЭДС гальванического элемента при изменении концентрации растворов, в которые погружены катод и анод, в одинаковое число раз
| а) увеличится на это число | г) будет в 2 раза больше |
| б) уменьшится на это число | д) будет в 2 раза меньше |
| в) не изменится |
11-65. ЭДС гальванического элемента Zn | Zn2+ || Cu2+ | Cu равна (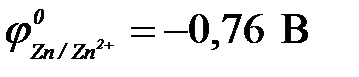 ,
, 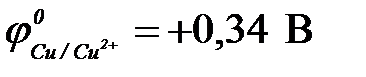 )
)
| а) 1,1 В | б) 0,42 В | в) –0,42 В | г) –1,1 В |
11-66. Наибольшая электродвижущая сила у гальванического элемента (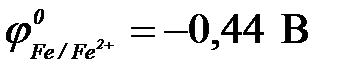 ,
, 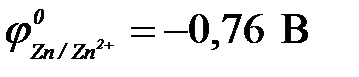 ,
, 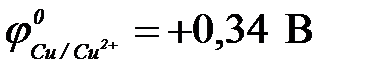 ,
,  ,
, 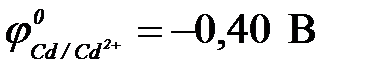 )
)
| а) Fe | Fe2+ || Cu2+ | Cu | в) Zn | Zn2+|| Cu2+ | Cu |
| б) Ni | Ni2+ || Cu2+ | Cu0 | г) Cd | Cd2+|| Cu2+ | Cu |
11-67. Соответствие между схемой гальванического элемента и величиной ЭДС (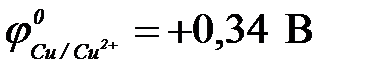 ,
, 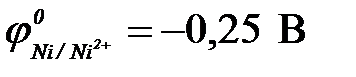 ,
, 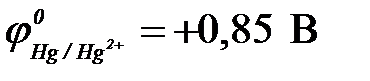 ,
, 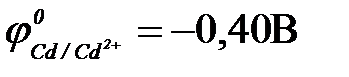 ,
, 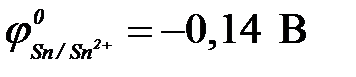 ).
).
| 1) | Cu | Cu2+ || Ni2+| Ni | а) | 0,59 В |
| 2) | Cu | Cu2+ || Hg2+| Hg | б) | 0,51 В |
| 3) | Cu | Cu2+ || Cd2+| Cd | в) | 0,74 В |
| 4) | Cu | Cu2+ || Sn2+| Sn | г) | 0,48 В |
| д) | 0,20 В | ||
| е) | 0,09 В |
11-68. Скорость электрохимической коррозии рассчитывается по формуле
а) 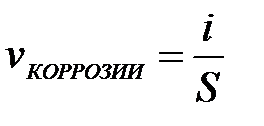
| в) 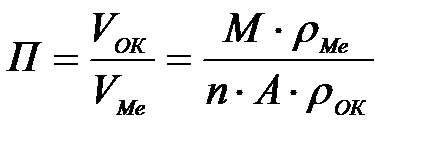
|
б) 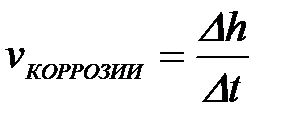
| г) 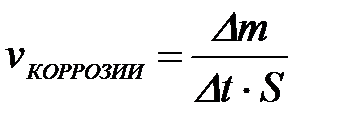
|
11-69. Глубинный показатель коррозии рассчитывается по формуле
а) 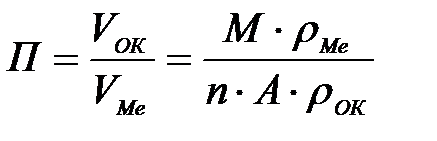
| в) 
|
б) 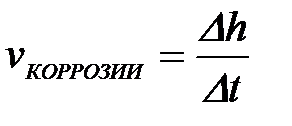
| г) 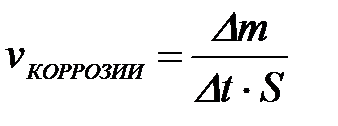
|
11-70. Фактор рыхлости при коррозии металлов рассчитывается по формуле
а) 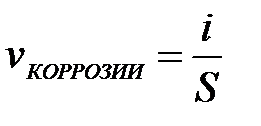
| в) 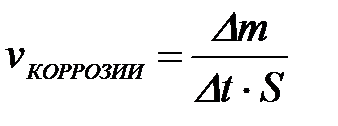
|
б) 
| г) 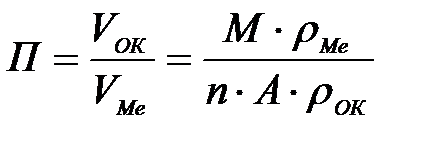
|
11-71. Массовый показатель коррозии рассчитывается по формуле
а) 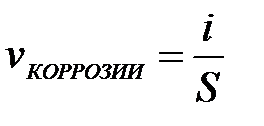
| в) 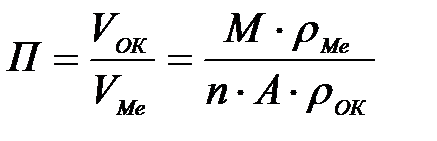
|
б) 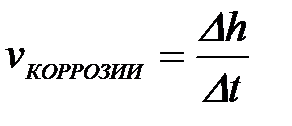
| г) 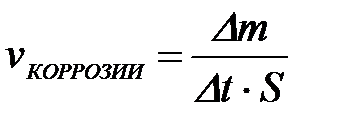
|
11-72. Местная коррозия показана на рисунке
| а) | 
| б) | 
| в) | 
|
11-73. Сплошная коррозия показана на рисунке
| а) | 
| б) | 
| в) | 
|
11-74. Условием возможности протекания коррозии является
а) 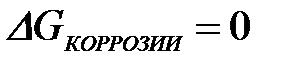
| в) 
|
б) 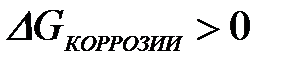
| г) 
|
11-75. Процесс самопроизвольного разрушения металла при взаимодействии с окислителем возможен
а) 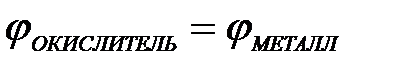
| в) 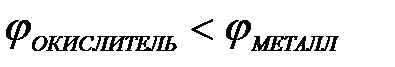
|
б) 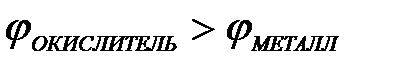
| г) 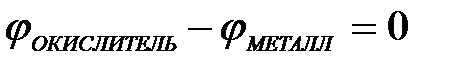
|
11-76. Первичный процесс коррозии железа в чистом влажном воздухе описывается уравнением
| а) 2Fe + O2 = 2FeO | в) 4Fe + 3O2 + 6H2O = 4Fe(OH)3 |
| б) 2Fe + O2 + 2H2O = 2Fe(OH)2 | г) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 |
11-77. Коррозией называется процесс
а) гетерогенного превращения металла в окружающей среде
б) самопроизвольного разрушения металла, происходящего при взаимодействии с окружающей средой
в) целенаправленного изменения металла, происходящего при взаимодействии с различными веществами
г) самопроизвольного восстановления металла, происходящего при взаимодействии с окружающей средой
11-78. Процесс коррозии представляет собой самопроизвольную реакцию ___ происходящую при взаимодействии с веществами, находящимися в окружающей среде.
| а) окисления металла | в) ионного обмена металла |
| б) восстановления металла | г) окисления-восстановления металла |
11-79. Коррозия по механизму протекания бывает
| а) химическая | в) механическая |
| б) электрохимическая | г) разрушительная |
11-80. Химическая коррозия протекает
а) в газовой среде в отсутствие влаги
б) в газовой среде при контакте двух металлов
в) во влажном воздухе
г) в атмосферном воздухе промышленных предприятий
11-81. Процессы окисления металла и восстановления окислителя при химической коррозии протекают ___ на поверхности металла
а) одновременно в одном месте
б) одновременно в различных местах
в) в различное время в одном месте
г) в различное время в различных местах
11-82. Процессы окисления металла и восстановления окислителя при электрохимической коррозии протекают ___ на поверхности металла
а) одновременно в одном месте
б) одновременно в различных местах
в) в различное время в одном месте
г) в различное время в различных местах
11-83. Механизм электрохимической коррозии
а) перенос электронов от металла к окислителю
б) одновременная работа множества микрогальванических элементов
в) перенос электронов между активными участками внутри металла
г) перенос электронов между активными участками на поверхности металла
11-84. Электрохимическая коррозия может протекать в следующих средах:
| а) влажный воздух | в) растворы солей | д) аргон |
| б) растворы кислот | г) растворы щелочей |
11-85. Катодный процесс, протекающий в чистом влажном воздухе,
| а) O02 + 4e = 2O-2 | в) 2H+ + 2e = H02 |
| б)O02 + 2H2O + 4e = 4OH- | г) 2H2O + 2e = H02 + 2OH- |
11-86. Катодный процесс, протекающий в кислой среде,
| а)2H+ + 2e = H02 | в) O02 + 4e = 2O-2 |
| б) 2H2O + 2e = H02 + 2OH- | г) O02 + 2H2O + 4e = 4OH- |
11-87. Анодный процесс, протекающий в чистом влажном воздухе,
| а) Me0 – ne = Men+ | в) 2Me0 + O2 = 2MeO |
| б) 2Me0 + O2 + 2H2O = 2Me(OH)2 | г) Me0 + 2H+ = Me2+ + H2# |
11-88. Анодный процесс, протекающий в кислой среде,
| а) Me0 – ne = Men+ | в) 2Me0 + O2 = 2MeO |
| б) 2Me0 + O2 + 2H2O = 2Me(OH)2 | г) Me0 + 2H+ = Me2+ + H2# |
11-89. Первичными продуктами электрохимической атмосферной коррозии металла во влажном воздухе являются
| а) оксиды металлов | в) соли металлов |
| б) гидроксиды металлов | г) сплавы металлов |
11-90. Первичными продуктами электрохимической коррозии металла в кислой среде являются
| а) оксиды металлов | в) соли металлов |
| б) гидроксиды металлов | г) сплавы металлов |
11-91. Реакция ___ протекает на катодных участках при электрохимической коррозии с водородной деполяризацией.
| а) 2H+ + 2e = H02 | в) O02 + 4e = 2O–2 |
| б) 2H2O + 2e = H02 + 2OH– | г) O02 + 2H2O + 4e = 4OH– |
11-92. Анодным называется покрытие
| а) более активным металлом | г) менее активным неметаллом |
| б) менее активным металлом | д) полимерное покрытие |
| в) более активным неметаллом |
11-93. Катодным называется покрытие
| а) более активным металлом | г) менее активным неметаллом |
| б) менее активным металлом | д) полимерное покрытие |
| в) более активным неметаллом |
11-94. Анодное покрытие является более эффективным при защите от коррозии, потому что
а) образует плотную пленку на поверхности металла
б) разрушается само при повреждении поверхности
в) способствует разрушению металла, находящегося под защитной пленкой
г) является более твердым и не повреждается
11-95. Катодное покрытие является менее эффективным при защите от коррозии, потому что
а) образует плотную пленку на поверхности металла
б) разрушается само при повреждении поверхности
в) способствует разрушению металла, находящегося под покрытием, при нарушении поверхности
г) является менее твердым и легко повреждается
11-96. Ингибиторами коррозии называются
а) вещества, ускоряющие процесс разрушения металла
б) вещества, замедляющие процесс разрушения металла
в) полимерные покрытия, наносимые для защиты металла от коррозии
г) керамические покрытия, наносимые для защиты от коррозии
11-97. Соответствие обозначений и их физического смысла в формуле 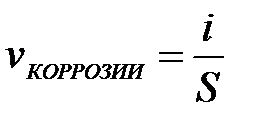 :
:
| 1) | 
| а) | скорость коррозии |
| 2) | 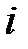
| б) | сила тока, возникающего при коррозии |
| 3) | 
| в) | площадь корродирующей поверхности |
| г) | объем продуктов коррозии | ||
| д) | площадь, занимаемая продуктами коррозии |
11-98. Соответствие обозначений и их физического смысла в формуле 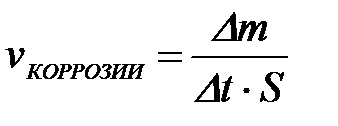 :
:
| 1) | 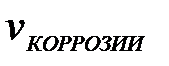
| а) | скорость коррозии |
| 2) | 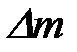
| б) | потеря массы изделия |
| 3) | 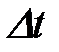
| в) | время коррозии |
| 4) | 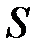
| г) | площадь корродирующей поверхности |
| д) | масса продуктов коррозии | ||
| е) | изменение температуры, происходящее при коррозии |
11-99. Анодным покрытием для железа (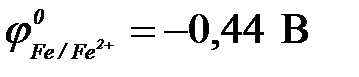 ) может служить
) может служить
а) цинк (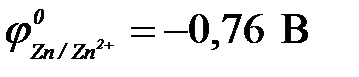 ) )
|
в) медь (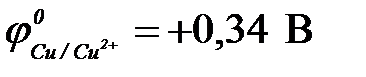 ) )
|
б) свинец (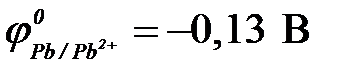 ) )
| г) серебро (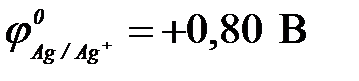 ) )
|
11-100. Катодным покрытием для меди (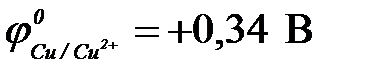 ) может служить
) может служить
а) цинк (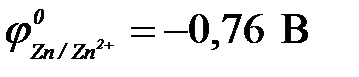 ) )
| в) железо (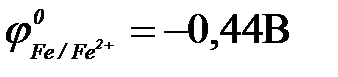 ) )
|
б) свинец (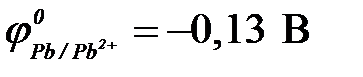 ) )
| г) серебро (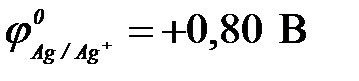 ) )
|
11-101. Анодным покрытием для цинка (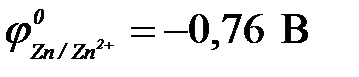 ) будет
) будет
а) кадмий (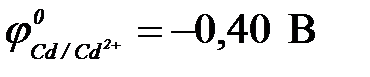 ) )
| в) железо ( ) )
|
б) никель (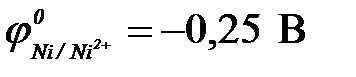 ) )
| г) алюминий (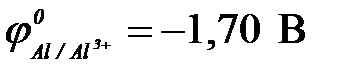 ) )
|
11-102. Протекторную защиту железа (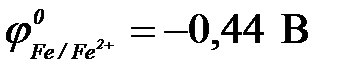 ) можно осуществить с помощью
) можно осуществить с помощью
а) цинка (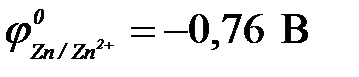 ) )
| в) алюминия (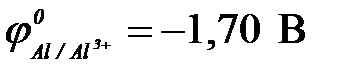 ) )
|
б) свинца (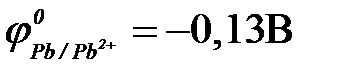 ) )
| г) серебра (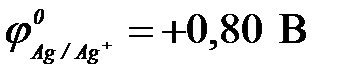 ) )
|
11-103. Катодному процессу при коррозии меди, покрытой оловом, при повреждении покрытия в сильно кислом растворе соответствует уравнение
| а) Cu2+ + 2e " Cu0 | в) O2 + 2H2O + 4e " 4OH– |
| б) Sn2+ + 2e " Sn0 | г) 2H+ + 2e " H20 |
11-104. Анодному процессу при коррозии меди ( ), покрытой оловом (
), покрытой оловом (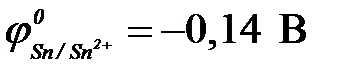 ), при повреждении покрытия в сильно кислой среде соответствует уравнение
), при повреждении покрытия в сильно кислой среде соответствует уравнение
| а) Cu0 – 2e = Cu2+ | в) O2 + 2H2O + 4e = 4OH– |
| б) Sn0 – 2e = Sn2+ | г) H02 – 2e = 2H+ |
11-105. Катодному процессу при коррозии оцинкованного железа во влажном воздухе при повреждении покрытия соответствует уравнение
| а) O2 + 2H2O + 4e = 4OH– | в) Zn2+ + 2e = Zn0 |
| б) Fe2+ + 2e = Fe0 | г) 2H+ + 2e = H20 |
11-106. Анодному процессу при коррозии оцинкованного железа (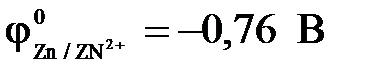 ,
, 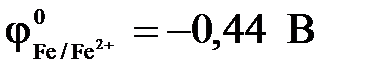 ) при повреждении покрытия соответствует уравнение
) при повреждении покрытия соответствует уравнение
| а) O2 + 2H2O + 4e = 4OH– | в) Zn0 – 2e = Zn2+ |
| б) Fe0 – 2e = Fe2+ | г) 2H+ + 2e = H20 |
11-107. Для протекторной защиты никеля (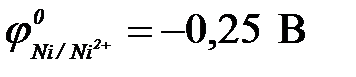 ) НЕ могут быть использованы
) НЕ могут быть использованы
а) цинк (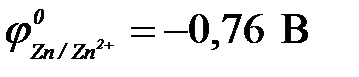 ) )
| в) алюминий (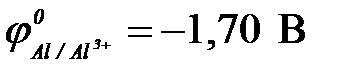 ) )
|
б) свинец (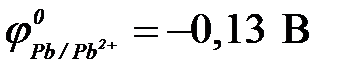 ) )
| г) серебро ( ) )
|
11-108. Первичный продукт коррозии оцинкованного железа (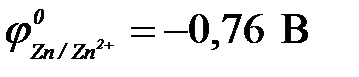 ,
, 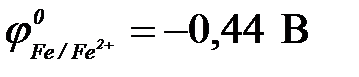 ) во влажном воздухе имеет состав
) во влажном воздухе имеет состав
| а) ZnSO4 | б) ZnO | в) Zn(OH)2 | г) FeSO4 | д) FeO |
11-109. Первичный продукт коррозии луженого железа (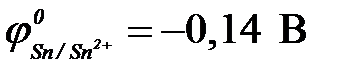 ,
, 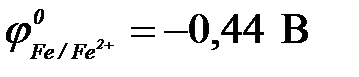 ) во влажном воздухе имеет состав
) во влажном воздухе имеет состав
| а) Sn(OH)2 | б) FeSO4 | в) FeO | г) Fe(OH)2 |
11-110. Протекторная защита корпуса стальной цистерны (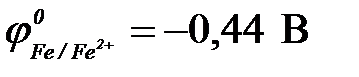 ) может быть осуществлена с помощью
) может быть осуществлена с помощью
а) свинца (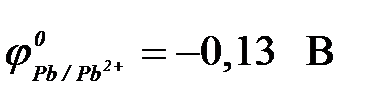 ) )
| в) марганца (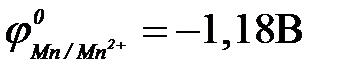 ) )
|
б) цинка (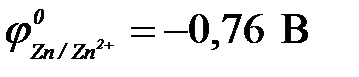 ) )
| г) никеля (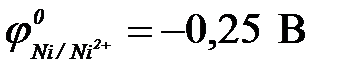 ) )
|
11-111. Протекторная защита корпуса стальной цистерны (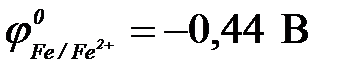 ) НЕ может быть осуществлена с помощью
) НЕ может быть осуществлена с помощью
а) свинца (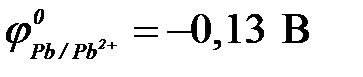 ) )
| в) марганца (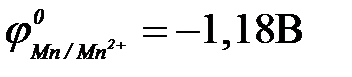 ) )
|
б) цинка (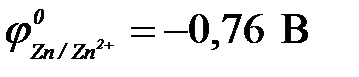 ) )
| г) никеля ( ) )
|
11-112. Протекторная защита корпуса стальной цистерны (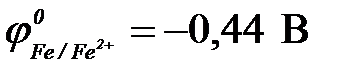 ) может быть осуществлена с помощью
) может быть осуществлена с помощью
а) алюминия (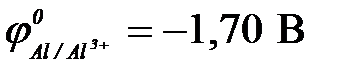 ) )
| в) кадмия (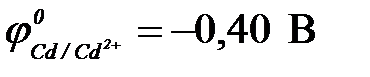 ) )
|
б) цинка (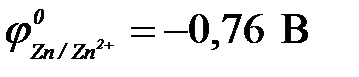 ) )
| г) никеля (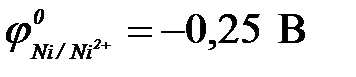 ) )
|
11-113. Продукты коррозии оцинкованного железа при повреждении покрытия в кислой среде (раствор HCl) будут (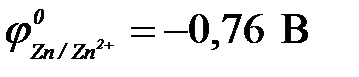 ,
,  )
)
| а) Zn и H2 | в) ZnCl2 и H2 |
| б) ZnCl2 и FeCl2 | г) FeCl2 и H2 |
11-114. Продуктами коррозии луженого железа при повреждении покрытия в кислой среде (раствор HCl) будут
| а) Sn и H2 | в) SnCl2 и H2 |
| б) SnCl2 и FeCl2 | г) FeCl2 и H2 |
11-115. Вблизи от места соединения медной заклепкой листов стали будут образовываться при коррозии в кислой среде (раствор HCl)
| а) Cu и H2 | в) CuCl2 и H2 |
| б) CuCl2 и FeCl2 | г) FeCl2 и H2 |
11-116. Блуждающие токи будут
а) усиливать коррозионное поражение
б) замедлять коррозию
в) не оказывают влияния на скорость разрушения
г) влияние зависит от условий эксплуатации изделия
_*_ _*_ _*_
11-117. Для защиты железа от коррозии в качестве катодного покрытия используется
| а) олово | б) цинк | в) алюминий | г) магний |
11-118. Для защиты железного изделия от коррозии в качестве анодного покрытия используют
| а) медь | б) олово | в) серебро | г) цинк |
11-119. ЭДС гальванического элемента, состоящего из медного и цинкового электродов, погруженных в 0,01М растворы их сульфатов (j0(Cu2+/Cu) = 0,34 B, j0(Zn2+/Zn) = –0,76 B), равна ____ В.
| а) 0,70 | б) 0,43 | в) 0,28 | г) 1,10 |
11-120. Для защиты железных изделий от коррозии в качестве катодного покрытия используется
| а) олово | б) магний | в) цинк | г) бериллий |
11-121. При нарушении цинкового покрытия на железном изделии во влажном воздухе на аноде будет протекает реакция, уравнение которой имеет вид
| а) Fe2+ + 2e = Fe0 | в) Fe0 – 2e = Fe2+ |
| б) Zn0 – 2e = Zn2+ | г) 2H2O + O2 + 4e = 4OH– |
11-122. Для защиты медных изделий от коррозии в качестве анодного покрытия можно использовать
| а) Al | б) Au | в) Pt | г) Ag |
11-123. При нарушении оловянного покрытия на железном изделии в кислоте на аноде будет протекать реакция
| а) Fe0 – 2e = Fe2+ | в) Sn0 – 2e = Sn2+ |
| б) 2H+ + 2e = H2 | г) Sn2+ + 2e = Sn0 |
11-124. При работе гальванического элемента, состоящего из железного и никелевого электродов, погруженных в 0,01М растворы их сульфатов, на аноде будет протекает реакция, уравнение которой имеет вид
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 2486; Нарушение авторских прав?; Мы поможем в написании вашей работы!