
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 8. Растворы электролитов
|
|
|
|
8-1. Электролиты – это вещества, растворы которых
| а) не проводят электрический ток | г) проводят тепло |
| б) проводят электрический ток | д) подкисляют раствор |
| в) не проводят тепло |
8-2. Неэлектролиты – это вещества, растворы которых
| а) не проводят электрический ток | г) проводят тепло |
| б) проводят электрический ток | д) подкисляют раствор |
| в) не проводят тепло |
8-3. Электролитами являются
| а) металлы | д) оксиды неметаллов |
| б) неметаллы | е) кислоты |
| в) оксиды металлов | ж) соли |
| г) основания | з) все органические вещества |
8-4. Уравнение процесса электролитической диссоциации:
| а) АВ D А+ + В– | в) А+ + В– D АВ |
| б) АВ D А0 + В0 | г) А+ + В– " АВ |
8-5. Значение ионного произведения воды:
| а) 7 | б) 14 | в) 18 | г) 1,8×10–16 | д) 1×10–14 |
8-6. рН раствора вычисляется по формуле:
а) 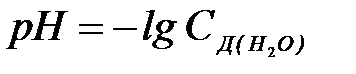
| в) 
|
б) 
| г) 
|
8-7. Электролиты классифицируют на сильные и слабые по величине
а) 
| б) 
| в) 
| г) 
| д) 
|
8-8. рН щелочного раствора:
| а) рН < 7 | б) рН = 7 | в) рН > 7 | г) не имеет рН |
8-9. Степенью электролитической диссоциации называется
а) электрическая проводимость раствора
б) отношение числа распавшихся на ионы молекул к общему числу всех молекул в растворе
в) отношение числа распавшихся на ионы молекул к числу молекул электролита в растворе
г) отношение числа ионов к изотоническому коэффициенту
8-10. Величина степени электролитической диссоциации зависит от
| а) температуры | г) концентрации раствора |
| б) природы растворителя | д) объема сосуда |
| в) цвета вещества | е) природы вещества |
8-11. Уравнения, описывающие свойства растворов, для электролитов и неэлектролитов различны, потому что электролиты
а) изменяют электропроводность раствора
б) связывают большее число молекул воды и уменьшают общее число частиц в растворе
в) распадаются на ионы и увеличивают число частиц в растворе
г) изменяют структуру воды
8-12. Гидролизу подвергаются соли, образованные
а) катионом слабого основания и анионом слабой кислоты
б) катионом слабого основания и анионом сильной кислоты
в) катионом сильного основания и анионом сильной кислоты
г) катионом сильного основания и анионом слабой кислоты
д) двузарядным катионом и однозарядным анионом
8-13. Степень гидролиза усиливается при
| а) повышении температуры | в) перемешивании раствора соли |
| б) добавлении воды | г) добавлении индикаторов |
8-14. Слабые электролиты имеют величину степени диссоциации
| а) 3% ³ a | Б) 0,03 £ a £ 0,3 | в) a £ 3% | г) a £ 0,3 |
8-15. Электролиты, при диссоциации которых из катионов образуются только катионы водорода и кислотные остатки, называются
| а) кислотными оксидами | в) основными оксидами | д) солями |
| б) основаниями | г) кислотами |
8-16. Электролиты, при диссоциации которых из анионов образуются только анионы OH– и катионы металла, называются
| а) кислотами | в) основаниями | д) солями |
| б) кислотными оксидами | г) основными оксидами |
8-17. Электролиты, при диссоциации которых образуются катионы металла и анионы кислотного остатка, называются
| а) кислотными оксидами | в) основаниями | д) кислотами |
| б) солями | г) основными оксидами |
8-18. Закон разбавления Оствальда имеет вид 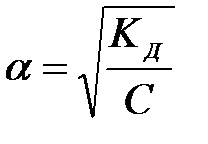 , где С – концентрация
, где С – концентрация
| а) молекул, не распавшихся на ионы | в) растворенного вещества |
| б) положительных ионов | г) отрицательных ионов |
8-19. Ионным произведением воды (КВ) называется
а) величина константы диссоциации воды
б) электропроводность чистой воды при стандартной температуре
в) произведение константы диссоциации воды на ее молярную концентрацию
г) логарифм величины константы диссоциации
8-20. Соответствие между степенью диссоциации веществ и силой электролита:
| 1) | Na2SO4 ( = 90%) = 90%)
| а) | неэлектролит |
| 2) | H2SO3 ( = 25%) = 25%)
| б) | высококипящее соединение |
| 3) | CH3COOH ( = 2, 5%) = 2, 5%)
| в) | средний |
| 4) | C12H22O11 ( = 0%) = 0%)
| г) | слабый |
| д) | сильный |
8-21. Сильные электролиты являются
а) NaOH (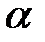 = 90%) = 90%)
| в) HCN (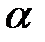 = 0,2%) = 0,2%)
| д) H3PO4 ( = 28%) = 28%)
|
б) Na2SO4 (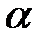 = 0,9) = 0,9)
| г) KNO3 ( = 90%) = 90%)
| е) H2S ( = 0,01%) = 0,01%)
|
8-22. Слабые электролиты являются
а) NaOH (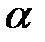 = 0,9) = 0,9)
| в) HCN ( = 0,2%) = 0,2%)
| д) H3PO4 (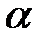 = 28%) = 28%)
|
б) Na2SO4 ( = 90%) = 90%)
| г) KNO3 (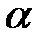 = 90%) = 90%)
| е) H2S (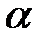 = 0,01%) = 0,01%)
|
8-23. Уравнение для вычисления произведения растворимости сульфида серебра Ag2S:
а)  или или 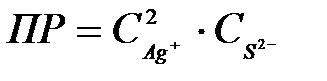
| г)  или или 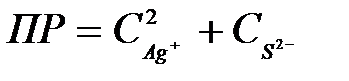
|
б) 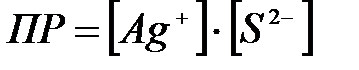 или или 
| д) 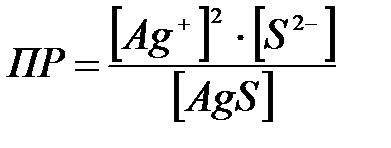 или или 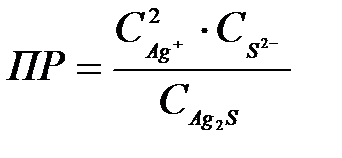
|
в) 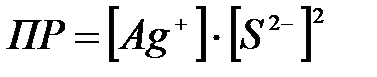 или или 
|
8-24. Соответствие между формулами электролитов и классом вещества:
| 1) | NaCl | а) | основание |
| 2) | Ba(OH)2 | б) | кислотный оксид |
| 3) | H4P2O7 | в) | металл |
| г) | соль | ||
| д) | кислота |
8-25. Выражение константы диссоциации 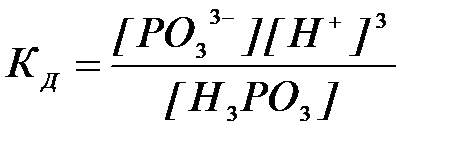 соответствует уравнению:
соответствует уравнению:
| а) H3PO3 D H+ + H2PO3– | в) HPO32– D H+ + PO33– |
| б) H2PO3– D H+ + HPO32– | г) H3PO3 D 3H+ + PO33– |
8-26. Среда, образуемая водным раствором Na2CO3,
| а) кислая | в) щелочная |
| б) нейтральная | г) индикаторная |
8-27. Соответствие между обозначением и его физическим смыслом в формуле 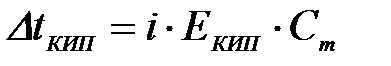 .
.
| 1) | 
| а) | температура кипения раствора |
| 2) | i | б) | степень диссоциации |
| 3) | 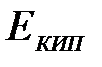
| в) | эбулиоскопическая постоянная |
| 4) | 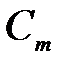
| г) | моляльная концентрация вещества |
| д) | повышение температуры кипения раствора | ||
| е) | понижение температуры кипения раствора | ||
| ж) | изотонический коэффициент |
8-28. Выражение  соответствует уравнению
соответствует уравнению
| а) H2CO3 D H+ + HCO3– | в) H2CO3 D 2H++ CO32– |
| б) HCO3– D H+ + CO32– | г) H2CO3 D H+2+ CO32– |
8-29. Среда, образуемая водным раствором Na2SO4
| а) кислая | в) щелочная | д) естественная |
| б) нейтральная | г) индикаторная |
8-30. Изотонический коэффициент раствора NaNO3 равен 1,8. Величина степени диссоциации α при этом
| а) 18% | б) 1,8 | в) 0,8 | г) 2 |
8-31. Степень диссоциации H2SO3 составила 25%. Тогда величина изотонического коэффициента i равна
| а) 0,25 | б) 1,5 | в) 3,0 | г) 1,25 |
8-32. Изотонический коэффициент раствора CH3COOH равен 1,04. Тогда величина степени диссоциации α
| а) 1,04 | б) 1,00 | в) 0,04 | г) 2,04 |
8-33. Уравнение первой стадии гидролиза Na2CO3
| а) Na+ + H2O D NaOH + H+ | в) CO32– + H2O D HCO3– + OH– |
| б) CO3– + H2O D HCO3 + OH– | г) HCO3– + H2O D H2CO3 + OH– |
8-34. Концентрация ионов H+ в растворе с рН = 1 составляет ___ моль/л.
8-35. рН раствора с концентрацией ионов водорода 1 моль/л равен ___
8-36. ПР хлорида серебра AgCl равно ___, если его растворимость составляет 1,07×10–5 моль/л.
| а) 1,07×10–5 | б) 2,14×10–5 | в) 1,14×10–10 | г) 1,14×10–5 |
_*_ _*_ _*_
8-37. Метиловый оранжевый окрашивается в розовый цвет в растворе
| а) K2CO3 | б) BaSO4 | в) Na2SO4 | г) Al2(SO4)3 |
8-38. Фенолфталеин окрашивается в малиновый цвет в растворе
| а) Na2CO3 | б) NaNO3 | в) FeCl3 | г) C6H12O6 |
8-39. Гидролизу по катиону подвергается соль
| а) FeCl3 | б) BaSO4 | в) K2CO3 | г) Na2SO4 |
8-40. Формула соли, водный раствор которой имеет кислую реакцию, –
| а) Na3PO4 | б) FeSO4 | в) Na2SO3 | г) NaCl |
8-41. Гидролизу по аниону подвергается соль
| а) CuSO4 | б) Na2SiO3 | в) KNO3 | г) AgCl |
8-42. Слабым электролитом является раствор
| а) соляной кислоты | в) хлорида натрия |
| б) уксусной кислоты | г) гидроксида натрия |
8-43. Формула соли, раствор которой проявляет щелочную реакцию, –
| а) CuSO4 | б) KCl | в) K2CO3 | г) Fe(NO3)2 |
8-44. В растворе карбоната натрия лакмус окрашивается в ___ цвет
| а) зеленый | б) фиолетовый | в) красный | г) синий |
8-45. Формула соли, которая не подвергается гидролизу, –
| а) K2CO3 | б) Al2S3 | в) K2SO4 | г) FeCl3 |
8-46. Вещество, изменяющее свою окраску в зависимости от рН среды, называется
| а) красителем | в) реагентом |
| б) индикатором | г) электролитом |
8-47. Для соединений NH4OH и NH4NO3 верно, что
а) только первое – сильный электролит
б) только второе – сильный электролит
в) оба – слабые электролиты
г) оба – сильные электролиты
8-48. Неверно, что в водных растворах слабых электролитов
а) степень диссоциации увеличивается при росте температуры
б) константа диссоциации не зависит от концентрации
в) константа диссоциации зависит от температуры
г) степень диссоциации уменьшается при разбавлении раствора
8-49. Для водных растворов солей AlCl3 и Na2CO3 верно, что
а) только во втором растворе среда щелочная
б) в обоих растворах среда кислая
в) в обоих растворах среда щелочная
г) только во втором растворе среда кислая
8-50. Гидролиз хлорида алюминия можно усилить, добавив в раствор
| а) хлорид цинка | в) воду |
| б) нитрат алюминия | г) соляную кислоты |
8-51. При одинаковой молярной концентрации веществ наибольшая концентрация ионов H+ в водном растворе
| а) CuCl2 | б) Na2CO3 | в) K2S | г) NH4OH |
8-52. Степень диссоциации уксусной кислоты в ее водном растворе можно уменьшить
| а) добавлением соляной кислоты | в) нагреванием |
| б) добавлением гидроксида натрия | г) добавлением воды |
8-53. Гидролиз в растворе хлорида железа (III) ослабляется при
| а) добавлении щелочи в раствор | в) добавлении воды |
| б) добавлении кислоты в раствор | г) нагревании раствора |
8-54. Сумма коэффициентов в сокращенном ионном уравнении взаимодействия растворов хлорида алюминия и карбоната натрия равна ___
| а) 15 | б) 17 | в) 19 | г) 13 |
8-55. Ионному произведению воды соответствует формула
| а) [H+]/[OH–] = 10–14 | в) [H+][OH–] = 10–14 |
| б) [H+][OH–] = 10–7 | г) [H+]=[OH–] = 10–14 |
8-56. Отношение числа молекул, диссоциирующих на ионы, к общему числу молекул, называется ___ диссоциации.
| а) показателем | б) степенью | в) константой | г) коэффициентом |
8-57. При разбавлении раствора степень диссоциации молекул электролита
| а) увеличивается | в) уменьшается |
| б) изменяется неоднозначно | г) не изменяется |
8-58. Раствор, в котором сохраняется значение рН при добавлении небольших количеств кислоты или основания, называется
| а) протолитическим | в) апротонным |
| б) буферным | г) амфотерным |
8-59. Для водных растворов справедливо соотношение
| а) рН + рОН = 14 | в) pH<pOH |
| б) рН + рОН = 7 | г) pH>pOH |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 606; Нарушение авторских прав?; Мы поможем в написании вашей работы!