
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 7. Растворы неэлектролитов
|
|
|
|
7-1. Массовая доля вещества в растворе вычисляется по формуле:
а) 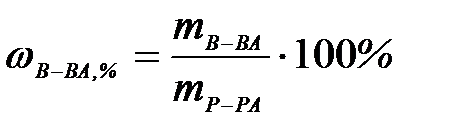
| в) 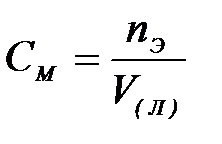
| д) 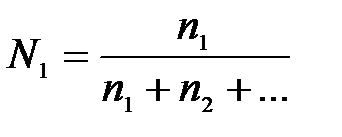
|
б) 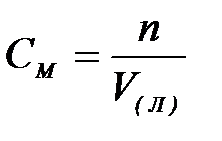
| г) 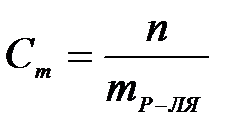
|
7-2. Молярная концентрация вещества в растворе вычисляется по формуле:
а) 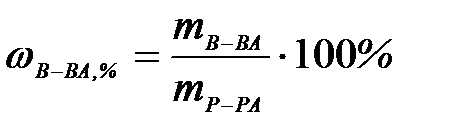
| в) 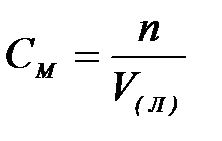
| д) 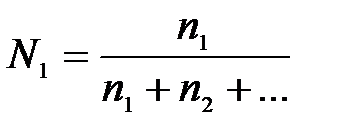
|
б) 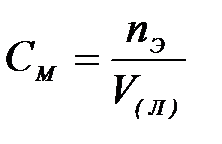
| г) 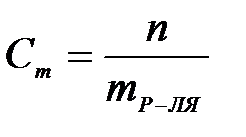
|
7-3. Нормальная концентрация вещества в растворе вычисляется по формуле:
а) 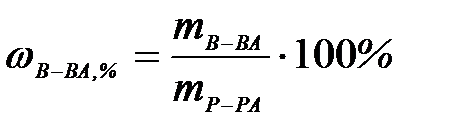
| в) 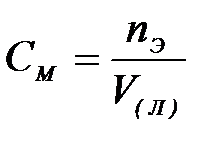
| д) 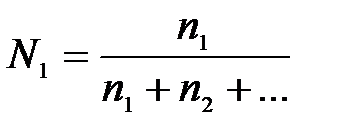
|
б) 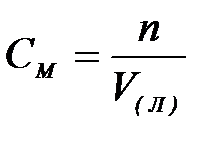
| г) 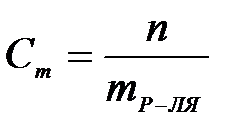
|
7-4. Моляльная концентрация вычисляется по формуле:
а) 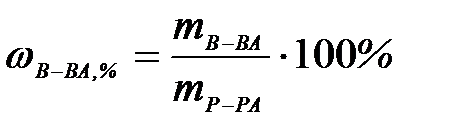
| в) 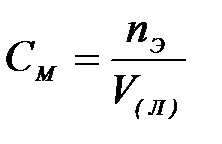
| д) 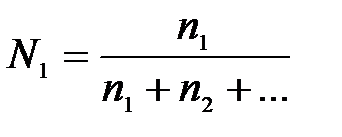
|
б) 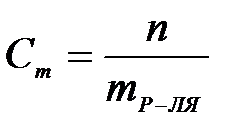
| г) 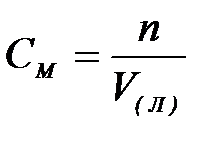
|
7-5. Мольная доля вещества вычисляется по формуле:
а) 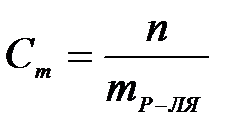
| в) 
| д) 
|
б) 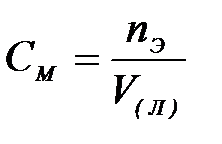
| г) 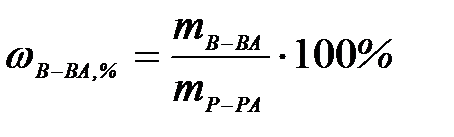
|
7-6. Растворами называют
а) гетерогенные системы, состоящие из нескольких компонентов
б) гомогенные системы, изолированные от окружающей среды
в) гомогенные системы, состоящие из 2-х или более компонентов и продуктов их взаимодействия
г) гомогенные системы, образующиеся в результате установления химического равновесия между 2-мя реагирующими веществами
7-7. Концентрация – это количественная мера
а) описания состава раствора
б) содержания растворенных веществ в растворе
в) содержания растворенного вещества в растворе
г) описания способа приготовления раствора
7-8. Гидратация – это взаимодействие растворенного вещества с
| а) любым растворителем | в) другим веществом |
| б) водой | г) окружающей средой |
7-9. Осмосом называют процесс
а) диффузии вещества при растворении
б) самопроизвольного переноса вещества через полупроницаемую мембрану
в) самопроизвольного переноса растворителя через полупроницаемую мембрану
г) самопроизвольного перемешивания раствора
7-10. Соответствие способа выражения концентрации и формул
| 1) | молярная концентрация | а) | 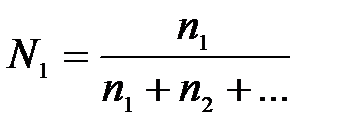
|
| 2) | нормальная концентрация | б) | 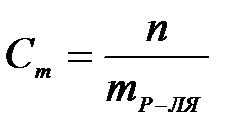
|
| 3) | массовая доля вещества | в) | 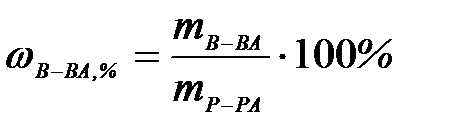
|
| 4) | мольная доля | г) | 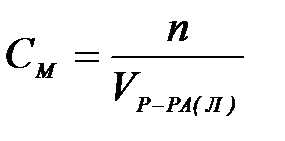
|
| 5) | моляльная концентрация | д) | 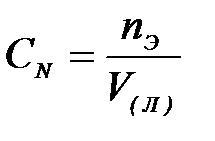
|
| е) | 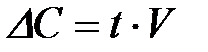
|
7-11. Закон Рауля: при постоянной температуре относительное понижение давления насыщенного пара растворителя над раствором равно ___ растворенного вещества.
| а) массовой доле | в) молярной концентрации |
| б) молярной концентрации | г) мольной доле |
7-12. Понижение температуры замерзания раствора прямопропорционально ___ растворенного вещества.
| а) массовой доле | в) моляльной концентрации |
| б) молярной концентрации | г) мольной доле |
7-13. Повышение температуры кипения вычисляется по формуле 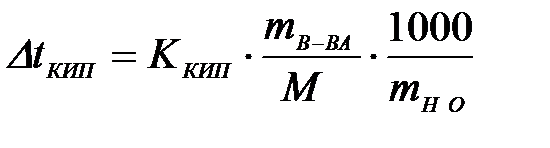 , где М
, где М
| а) масса вещества | в) молярная масса вещества |
| б) масса растворителя | г) молярная масса растворителя |
7-14. Температура замерзания раствора
а) равна температуре замерзания растворителя
б) выше температуры замерзания растворителя
в) ниже температуры замерзания растворителя
г) равна температуре замерзания растворенного вещества
д) зависит от агрегатного состояния растворителя
7-15. Соответствие между обозначением и его физическим смыслом в уравнении закона Вант-Гоффа 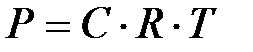 :
:
| 1) | Р | а) | осмотическое давление |
| 2) | С | б) | нормальная концентрация |
| 3) | R | в) | универсальная газовая постоянная |
| 4) | T | г) | время измерений |
| д) | молярная концентрация | ||
| е) | абсолютная температура | ||
| ж) | атмосферное давление |
7-16. Соответствие между обозначением и его физическим смыслом в формуле 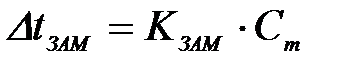 :
:
| 1) | 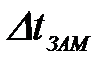
| а) | температура замерзания |
| 2) | 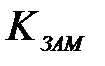
| б) | криоскопическая постоянная |
| 3) | 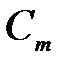
| в) | моляльная концентрация. |
| г) | понижение температуры замерзания | ||
| д) | повышение температуры замерзания | ||
| е) | молярная концентрация |
7-17. Осмотическое давление зависит от
| а) природы растворителя | г) концентрации растворенного вещества |
| б)температуры | д) объема раствора |
| в) природы вещества |
7-18. Зависимость растворимости газов от парциального давления
| а) | в) | ||||
| б) | г) |
7-19. Установите соответствие между способом выражения концентрации вещества в растворе и размерностью:
| 1) | нормальная | а) | %/кг |
| 2) | моляльная | б) | безразмерная |
| 3) | молярная | в) | моль/л |
| 4) | массовая доля | г) | моль/кг |
| 5) | процентная концентрация | д) | % массовые |
| е) | моль-экв/л | ||
| ж) | мольная доля |
7-20. Масса гидроксида натрия, необходимого для приготовления 200 г 20%-ного раствора,
| а) 4 г | б) 40 г | в) 400 г | г) 10 г |
7-21. Масса гидроксида натрия, необходимого для приготовления 3 л 10%-ного раствора плотностью 1,109 г/мл,
| а) 300 г | б) 300 мл | в) 332,7мл | г) 332,7г |
7-22. Масса азотной кислоты, содержащейся в 100 миллилитрах 0,2 М раствора (молярная масса кислоты 63 г/моль),
| а) 1,26 г | б) 20 г | в) 0,1 г | г) 63 г |
7-23. Раствор, содержащий в 300 мл 10,5 г КОН, имеет молярную концентрацию (молярная масса гидроксида калия 56 г/моль)
| а) 0,625 М | б) 0,3 М | в) 0,105 М | г) 56 М |
_*_ _*_ _*_
7-24. Смешали 200 г 20%-ного и 300 г 10%-ного растворов глюкозы. Рассчитайте массовую долю глюкозы в полученном растворе.
| а) 15% | б) 18% | в) 14% | г) 16% |
7-25. Объем аммиака (н.у.), необходимый для получения 15%-ного раствора аммиака из 500 г 10% раствора, равен ___ л.
| а) 16,05 | б) 38,75 | в) 32,94 | г) 44,8 |
7-26. Масса воды, необходимая для приготовления 400 г 20%-ного раствора нитрата калия, равна
| а) 160 г | б) 320 г | в) 360 г | г) 80 г |
7-27. Масса растворенного вещества в 500 мл 0,1М раствора серной кислоты равна
| а) 4,9 г | б) 49 г | в) 9,8 г | г) 24,5 г |
7-28. Молярная концентрация раствора, в 2 л которого содержится 19,6 г серной кислоты, равна ____ моль/л.
| а) 0,2 | б) 0,1 | в) 1,0 | г) 0,5 |
7-29. Масса соли, необходимая для приготовления 200 мл 10%-ного раствора хлорида натрия (r = 1,1 г/мл), равна
| а) 20 | б) 44 | в) 22 | г) 40 |
7-30. 50 г сахарозы растворили в 450 г воды. Массовая доля растворенного вещества в растворе равна
| а) 15% | б) 10% | в) 22% | г) 20% |
7-31. Масса соли, необходимой для приготовления 2 л 0,2М раствора сульфата магния, равна
| а) 96 | б) 48 | в) 24 | г) 72 |
7-32. Массовая доля фосфата калия в растворе, полученном при растворении 0,5 моль соли в 124 мл воды, равна
| а) 69% | б) 23% | в) 46% | г) 72% |
7-33. Масса растворенного вещества в 500 мл 25%-ного раствора фосфорной кислоты (rr = 1,2 г/мл) равна
| а) 100 г | б) 104 г | в) 150 г | г) 250 г |
7-34. Молярная концентрация 1 л 36,5%-ного раствора соляной кислоты (r = 1,18 г/мл) составляет ____ моль/л.
| а) 11,8 | б) 5 | в) 5,6 | г) 10 |
7-35. В 2 л 10%-ного раствора фосфорной кислоты (r = 1,05 г/мл) содержится ____ граммов растворенного вещества.
| а) 420 | б) 105 | в) 200 | г) 210 |
7-36. Для приготовления 500 г 10%-ного раствора нитрата натрия необходимо навеску соли растворить в ___ граммах воды.
| а) 50 | б) 500 | в) 450 | г) 400 |
7-37. Масса растворенного вещества в растворе, полученном при сливании 160 г 5%-ного и 240 г 10%-ного растворов, равна ____ г.
| а) 32 | б) 24 | в) 400 | г) 40 |
7-38. В 400 мл 0,2М раствора нитрата натрия содержится ___ граммов соли.
| а) 6,8 | б) 68 | в) 34 | г) 13,6 |
7-39. Для приготовления 0,5 л 0,2М раствора глюкозы необходимо растворить ___ г вещества.
| а) 9 | б) 90 | в) 45 | г) 18 |
7-40. Концентрация раствора глюкозы, кипящего при 100,78 ˚С (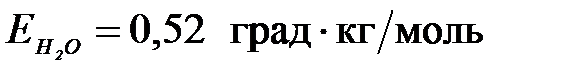 ), равна
), равна
| а) 0,3 моль/кг | б) 1 моль/кг | в) 0,5 моль/кг | г) 1,5 моль/кг |
7-41. Растворы, обладающие одинаковым осмотическим давлением, называются
| а) гипертоническими | в) гипотоническими |
| б) изотоническими | г) изотермическими |
7-42. Молярная масса неэлектролита, раствор 6 г которого в 100 мл воды (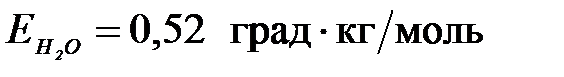 ) кипит при 100,52 ˚С, равна ____ г/моль.
) кипит при 100,52 ˚С, равна ____ г/моль.
| а) 6 | б) 60 | в) 3 | г) 30 |
7-43. Молярная масса неэлектролита, раствор 11,6 г которого в 200 г воды замерзает при –1,86 ˚С (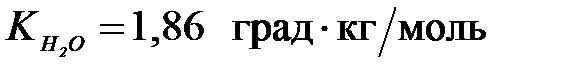 ), равна ____ г/моль.
), равна ____ г/моль.
| а) 29 | Б) 58 | в) 116 | г) 232 |
7-44. Для повышения температуры кипения раствора на 1,04 ˚С (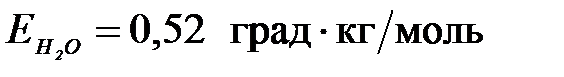 ) необходимо, чтобы концентрация растворенного в нем неэлектролита составляла ____ моль/кг.
) необходимо, чтобы концентрация растворенного в нем неэлектролита составляла ____ моль/кг.
| а) 2 | б) 0,5 | в) 0,2 | г) 1 |
7-45. Уравнение PОСМ = CRT (закон Вант-Гоффа), характеризующее зависимость осмотического давления от концентрации и температуры, применимо
а) только к растворам сильных электролитов
б) к растворам слабых электролитов
в) к любым растворам
г) только к растворам неэлектролитов
7-46. Раствор, содержащий 9,2 г этилового спирта в 200 г воды (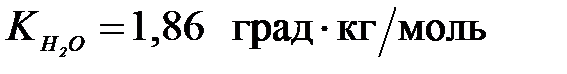 ), будет замерзать при температуре ___ ˚С.
), будет замерзать при температуре ___ ˚С.
| а) –1,86 | б) –0,186 | в) 0,186 | г) 1,86 |
7-47. Молярная масса неэлектролита, раствор 9,2 г которого в 400 г воды замерзает при –0,93 ˚С (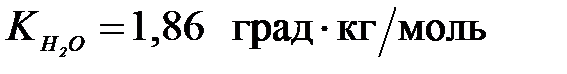 ), равна ___ г/моль.
), равна ___ г/моль.
| а) 60 | б) 92 | в) 120 | г) 46 |
7-48. Раствор, содержащий 12 г мочевины (MR = 60) в 100 г воды (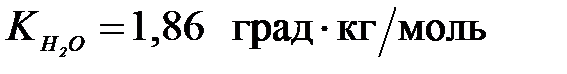 ), будет замерзать при температуре _____ ˚С.
), будет замерзать при температуре _____ ˚С.
| а) –3,72 | б) –0,372 | в) 3,72 | г) –1,86 |
7-49. Раствор, содержащий 46 г глицерина (MR = 92) в 100 г воды (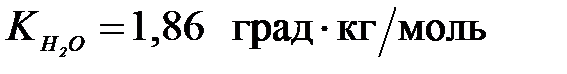 ), будет замерзать при температуре ___ ˚С.
), будет замерзать при температуре ___ ˚С.
| а) –4,65 | б) 9,3 | в) –9,3 | г) –1,86 |
7-50. В 50 граммах 10%-ного раствора NaCl содержится ___ молекул воды.
| а) 3,01ּ1024 | б) 3,01ּ1023 | в) 1,505ּ1024 | г) 6,02ּ1024 |
7-51. Объем аммиака (н.у.), содержащийся в 50 граммах 20%-ного раствора NH3, равен
| а) 13,2 мл | б) 1,32 л | в) 13,2 л | г) 1,32 мл |
7-52. Молярная концентрация HNO3 в 250 мл раствора, содержащего 12,6 г кислоты, равна ___ моль/л.
| а) 0,2 | б) 0,8 | в) 2,0 | г) 8,0 |
7-53. Массовая доля HCl в растворе соляной кислоты, полученном при растворении 5,6 л хлороводорода (н.у.) в 1 литре воды, составляет ___ %.
| а) 9 | б) 0,9 | в) 0,45 | г) 4,5 |
7-54, Осмотическое давление раствора глюкозы с молярной концентраций 0,1 моль/л при 25 ˚С равна ___ кПа.
| а) 51,6 | б) 247,6 | в) 123,8 | г) 61,9 |
7-55. Осмотическое давление раствора глицерина с молярной концентрацией 0,1 моль/л при 25 ˚С равно ___ кПа.
| а) 123,8 | б) 247,6 | в) 51,6 | г) 61,9 |
7-56. В растворе нитрата калия объемом 0,5 л и концентрацией 0,1 моль/л, содержится ___ г растворенного вещества.
| а) 50,5 | б) 5,05 | в) 101 | г) 10,1 |
7-57. Раствор, содержащий 18 г глюкозы в 100 г воды будет замерзать при ___ ˚С (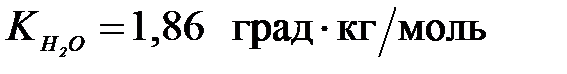 ).
).
| а) -1,86 | б) -0,186 | в) -3,72 | г) 0,186 |
7-58. Раствор, содержащий 11,6 г вещества в 400 г воды, замерзает при –0,93 ˚С (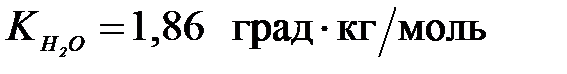 ). Молярная масса растворенного вещества равна ___ г/моль.
). Молярная масса растворенного вещества равна ___ г/моль.
| а) 116 | б) 87 | в) 58 | г) 29 |
7-59. Осмотическое давление раствора этанола с молярной концентрацией 0,5 моль/л при 20 ˚С равно ___ кПа.
| а) 609 | б) 1217 | в) 2435 | г) 4970 |
7-60. Концентрация раствора этиленгликоля (тосол), замерзающего при -37,2 ˚С (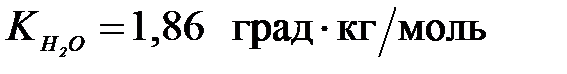 ), составляет ____ моль/кг.
), составляет ____ моль/кг.
| а) 20 | б) 2 | в) 10 | г) 40 |
7-61. Раствор, содержащий 4,6 г глицерина (Mr = 92) в 100 г воды (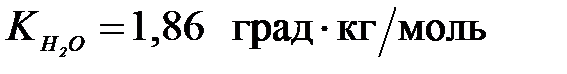 ), замерзает при температуре ___ ˚С.
), замерзает при температуре ___ ˚С.
| а) –0,93 | б) –0,465 | в) –0,186 | г) –0,372 |
7-62. В растворе гидроксида натрия объемом 2 л и концентрацией 0,5 моль/л содержится ___ г растворенного вещества.
| а) 60 | б) 40 | в) 20 | г) 80 |
7-63. В растворе серной кислоты объемом 0,5 л и концентрацией 0,1 моль/л содержится ___ г растворенного вещества.
| а) 98 | б) 9,8 | в) 4,9 | г) 49 |
7-64. Молярная концентрация раствора, в 200 мл которого содержится 12 г уксусной кислоты, равна ___ моль/л.
| а) 1 | б) 0,5 | в) 2 | г) 0,2 |
7-65. Моляльная концентрация имеет размерность
| а) моль/л | б) г/моль | в) моль/кг | г) л/моль |
7-66. Мольная доля растворенного вещества может быть выражена в
| а) г/моль | б) процентах | в) моль/кг | г) моль/л |
7-67. В 400 г раствора гидроксида натрия с массовой долей растворенного вещества 10% содержится ___ моль NaOH.
| а) 0,5 | б) 0,1 | в) 1 | г) 2 |
7-68. Для приготовления 500 г с моляльной концентрацией 0,5 моль/кг раствора CuSO4 требуется ___ г растворенного вещества.
| а) 80 | б) 160 | в) 40 | г) 20 |
7-69. Массовая доля растворенного вещества может быть выражена в
| а) моль/кг | в) г/моль |
| б) г/л | г) долях или % |
7-70. Для приготовления 500 г раствора NaOH с моляльной концентрацией 1 моль/кг требуется ___ г растворенного вещества.
| а) 60 | б) 20 | в) 80 | г) 40 |
7-71. Мольная доля растворенного вещества может быть выражена в
| а) моль/кг | в) г/моль |
| б) моль/л | г) долях или % |
7-72. Молярная концентрация раствора, в 500 мл которого содержится 16 г сульфата меди, равна ___ моль/л.
| а) 1 | б) 0,1 | в) 0,2 | г) 2 |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1376; Нарушение авторских прав?; Мы поможем в написании вашей работы!