
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 4. Химическое равновесие
|
|
|
|
4-1. Смещение положения химического равновесия описывает
а) закон сохранения массы веществ М.В.Ломоносова
б) принцип Ле-Шателье
в) периодический закон Д.И.Менделеева
г) правило Вант-Гоффа
д) уравнение Аррениуса
е) 1-й закон термодинамики
4-2. Положение химического равновесия зависит от
| а) температуры | г) перемешивания |
| б) концентрации реагирующих веществ | д) катализатора |
| в) цвета веществ | е) индикатора |
4-3. Обратимая реакция
| а) A + B = AB | в) A + B! AB |
| б) A + B AB | г) A + B D AB |
4-4. Общий вид выражения константы равновесия для реакции, уравнение которой Aa + Bb D dD + pP:
а) 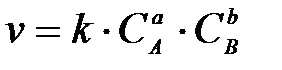
| г) 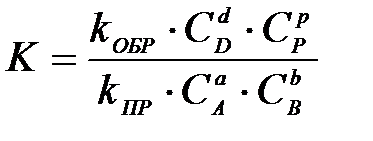
|
б) 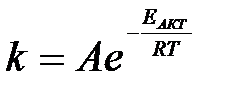
| д) 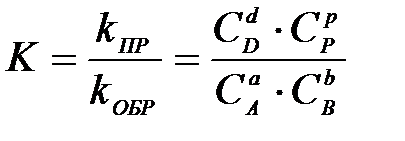
|
в) 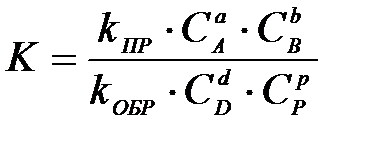
|
4-5. Совокупность однородных (по химическим и физическим свойствам) частей системы называется
| а) энтропией | г) фазой |
| б) энтальпией | д) раствором |
| в) структурой |
4-6. Химическое равновесие – это такое состояние системы, когда
а) скорость прямой реакции больше скорости обратной реакции
б) скорость прямой реакции меньше скорости обратной реакции
в) скорость прямой реакции равна скорости обратной реакции
г) реакция протекает лишь в одном направлении
4-7. Реакции, в результате протекания которых выпадает осадок, выделяется газ или образуется малодиссоцирующее вещество, называются
| а) обратимыми | в) равновесными |
| б) необратимыми | г) неравновесными |
4-8. Рисунок, изображающий состояние равновесия:
| а) | в) | ||||
| б) | г) |
4-9. Кинетическое условие равновесия системы A + B D AB:
а) 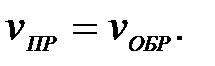
| в) 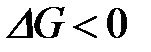
| д) 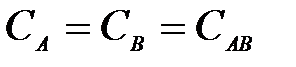
|
б) 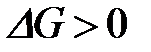
| г) 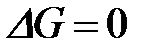
| е) 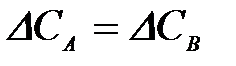
|
4-10. Термодинамическое условие равновесия системы A + B D AB:
а) 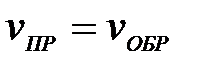
| в) 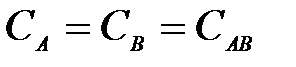
| д) 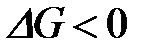
|
б) 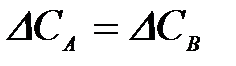
| г) 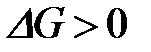
| е) 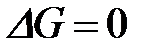
|
4-11. Принцип Ле-Шателье: если на систему, которая находится в состоянии равновесия, оказать внешнее воздействие, то положение равновесия сместится в сторону
а) той реакции, которая ослабляет это воздействие
б) той реакции, которая усиливает это воздействие
в) прямой реакции
г) обратной реакции
4-12. Положение равновесия смещено в сторону ___ реакции при KP > 1.
| а) прямой | в) равновесной |
| б) обратной | г) обратимой |
4-13. Положение равновесия смещено в сторону ___ реакции при KP < 1.
| а) прямой реакции | в) равновесной реакции |
| б) обратной реакции | г) обратимой реакции |
4-14. Выражение константы равновесия системы
CH4(Г) + CO2(Г) D 2CO(Г) +2H2(Г):
а) 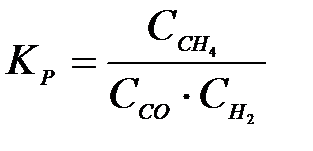
| в) 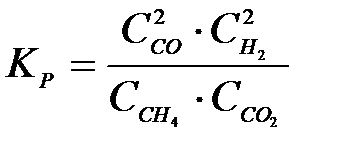
|
б) 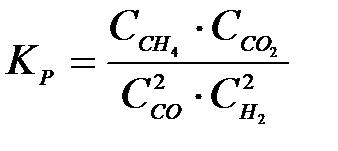
| г) 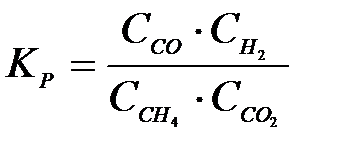
|
4-15. Выражение константы равновесия системы 2H2S(Г) D 2H2(Г) + S2(Т):
а) 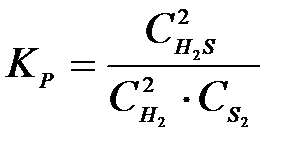
| в) 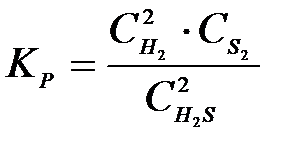
|
б) 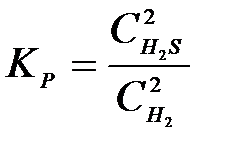
| г) 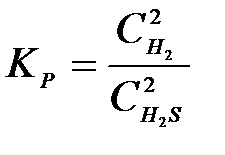
|
4-16. Положение равновесия системы 2NO2(Г) D 2NO(Г) + O2(Г) зависит от
| а) давления | в) увеличения концентрации NO2 |
| б) добавления катализатора | г) изменения температуры |
4-17. Повышение температуры вызовет смещение равновесия системы
N2(Г) + O2(Г) D 2NO(Г); DH = 180 кДж/моль
а) в сторону обратной реакции
б) в сторону прямой реакции
в) не сместит равновесие
г) увеличит количество образующихся веществ
д) уменьшит количество образующихся веществ
4-18. Константа равновесия имеет вид 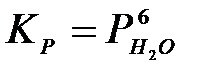 для системы:
для системы:
а) 3O2(Г) + 12HCl(Г) D 6H2O(ПАР) + 3Cl2(Г)
б) 6Cl2(Г) + 6H2O(Ж) D 6HCl(Ж) + 6HClO(Ж)
в) 6Na(Т) + 6H2O(Ж) D 6NaOH(Т) + 3H2(Г)
г) CaCl2×6H2O(Т) D CaCl2(Т) + 6H2O(ПАР)
4-19. Влево будут смещать положение равновесия системы
N2(Г) + O2(Г) D 2NO(Г); DH = 180 кДж
| а) уменьшение давления | г) повышение температуры |
| б) понижение температуры | д) уменьшение концентрации NO |
| в) повышение давления | е) увеличение концентрации NO |
4-20. Давление не будет изменять положение равновесия в системе:
| а) N2(Г) + O2(Г) D 2NO(Г) | в) 2NO2(Г) D 2NO(Г) + O2(Г) |
| б) 3O2(Г) + 12HCl(Г) D 6H2O(ПАР) + 3Cl2(Г) | г) CH4(Г) + CO2(Г) D 2CO(Г) + 2H2(Г) |
4-21. Положение равновесия системы MgCO3(Т) D MgO(Т) + CO2(Г); DH > 0 будет смещаться при повышении температуры
| а) в сторону исходных веществ | в) влево |
| б) в сторону продуктов реакции | г) не будет изменять своего положения |
4-22. Соответствие между обозначениями в формуле 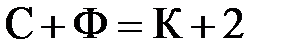 и их физическим смыслом
и их физическим смыслом
| 1) С | а) элемент калий |
| 2) Ф | б) число степеней свободы системы |
| 3) К | в) число компонентов |
| 4) 2 | г) число влияющих внешних факторов |
| д) концентрация физическая постоянная | |
| е) число фаз в системе |
4-23. Соответствие между воздействием на систему
H2(Г) + S(Т) D H2S(Г); DH < 0 и направлением смещения равновесия.
| 1) повышение температуры | а) положение равновесия не изменяется |
| 2) уменьшение концентрации H2S | б) в сторону обратной реакции |
| 3) увеличение давления | в) сера выпадает в осадок |
| г) в сторону прямой реакции |
4-24. Константа равновесия системы 2NO2 D 2NO + O2 при равновесных концентрациях 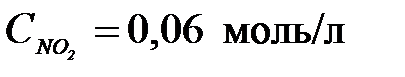 ,
, 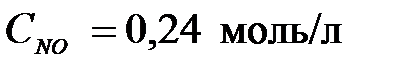 ,
, 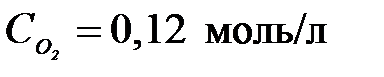 равна
равна
| а) 0,1152 | б) 0,48 | в) 1,92 | г) 5,21 |
4-25. Константа равновесия гомогенной системы A + B D 2С при равновесных концентрациях 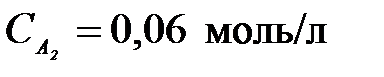 ,
, 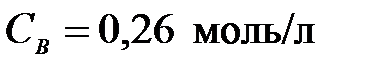 ,
, 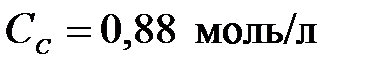 равна
равна
| а) 56,41 | г) 0,36 |
| б) 49,64 | д) 42 |
| в) 0,018 |
4-26. Повышение температуры сместит положение равновесия системы
N2(Г) + O2(Г) D 2NO(Г); DH = 180 кДж в ту же сторону, что и
| а) понижение давления | в) повышение концентрации NO |
| б) повышение давления | г) понижение концентрации NO |
_*_ _*_ _*_
4-27. Для смещения равновесия в системе H2(Г) + S(Т) D H2S(Г), DH = –21 кДж в сторону образования сероводорода необходимо
| а) повысить давление | в) понизить температуру |
| б) понизить давление | г) повысить температуру |
4-28. Для увеличения выхода продуктов реакции
2Pb(NO3)2(Т) D 2PbO(Т) + 4NO2(Г) + O2(Г), DH0 > 0 необходимо
| а) увеличить температуру | б) ввести катализатор |
| в) увеличить давление | г) уменьшить температуру |
4-29. Для смещения равновесия в системе
CaCO3(Т) D CaO(Т) + CO2(Г); DH > 0 в сторону продуктов реакции необходимо
| а) увеличить давление | в) увеличить температуру |
| б) ввести катализатор | г) уменьшить температуру |
4-30. Для смещения равновесия в системе
MgO(Т) + CO2(Г) D MgCO3(Т), DH<0
в сторону продуктов реакции необходимо
| а) понизить давление | в) повысить температуру |
| б) понизить температуру | г) ввести катализатор |
4-31. Для смещения равновесия в системе SO2(Г) + Cl2(Г) D SO2Cl2(Г), DH<0 в сторону продуктов реакции необходимо
| а) ввести катализатор | в) понизить давление |
| б) понизить температуру | г) понизить концентрацию SO2 |
4-32. Для увеличения выхода аммиака по уравнению реакции
N2(Г) + 3H2(Г) D 2NH3(Г), DH < 0 необходимо
| а) повысить концентрацию NH3 | в) понизить давление |
| б) понизить концентрацию азота | г) уменьшить температуру |
4-33. Для смещения равновесия в системе SO2(Г) + Cl2(Г) D SO2Cl2(Г), DH<0 в сторону продуктов реакции необходимо
| а) понизить концентрацию SO2 | в) понизить давление |
| б) понизить температуру | г) ввести катализатор |
4-34. При увеличении давления в системе H2(Г) + I2(Г) D 2HI(Г), DHO < 0,
а) увеличивается содержание продуктов
б) увеличивается содержание продуктов и исходных веществ
в) состояние равновесия не изменяется
г) увеличивается содержание исходных веществ
4-35. При увеличении давления в системе H2(Г) + Br2(Г) D 2HBr(Г), DH0 < 0
а) увеличивается содержание продуктов
б) состояние равновесия не изменяется
в) увеличивается содержание исходных веществ
г) увеличивается содержание продуктов и исходных веществ
4-36. При увеличении давления в системе CO(Г) + 2H2(Г) D CH3OH(Г), DH0 < 0,
а) увеличивается выход продуктов
б) уменьшается выход продуктов
в) состояние равновесия меняется неоднозначно
г) состояние равновесия не изменяется
4-37. Для смещения равновесия в системе CO(Г) + 2H2(Г) D CH3OH(Г), DH0 < 0 в сторону продуктов реакции необходимо
| а) понизить давление | б) понизить концентрацию водорода |
| в) повысить давление | г) повысить температуру |
4-38. При увеличении температуры в системе
C2H2(Г) + H2О(Г) D C2H5OH(Г), DH0 < 0 равновесие
| а) не изменится | в) сместится в сторону продуктов реакции |
| б) изменится неоднозначно | г) сместится в сторону исходных веществ |
4-39. Для смещения равновесия в системе H2(Г) + I2(Г) D 2HI(Г), DH < 0 в сторону исходных веществ необходимо
а) уменьшить температуру
б) увеличить концентрацию йода
в) увеличить давление
г) уменьшить концентрацию йода
4-40. Для смещения равновесия в системе BaO(Т) + CO2(Г) D BaCO3(Т), DH0 < 0, в сторону продуктов реакции необходимо
| а) ввести ингибитор | в) понизить давление |
| б) понизить температуру | г) ввести катализатор |
4-41. Повышение температуры вызывает смещение равновесия в сторону ___ процесса.
| а) адиабатического | в) изотермического |
| б) экзотермического | г) эндотермического |
4-42. Состояние равновесия характеризуется равенством
а) температуры продуктов и исходных веществ
б) количества вещества в системе
в) концентраций продуктов и исходных веществ
г) скоростей прямого и обратного процессов
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1094; Нарушение авторских прав?; Мы поможем в написании вашей работы!