
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 3. Химическая кинетика
|
|
|
|
3-1. Формула средней скорости гомогенной реакции
а) 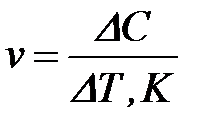
| б) 
| в) 
| г) 
|
3-2. Математическая зависимость скорости реакции от температуры описывается
| а) уравнением Аррениуса | г) уравнением Де-Бройля |
| б) уравнением Планка | д) принципом Ле-Шателье |
| в) правилом Вант-Гоффа |
3-3. Уравнение, описывающее зависимость скорости реакции от температуры,
а) 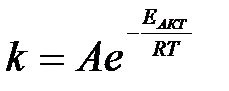
| в) 
|
б) 
| г) 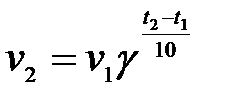
|
3-4. Значения температурного коэффициента скорости реакции γ
| а) 2, 3, 4, 5, 6 | г) изменяется от 2 до 8 |
| б) –2, –1, 0, +1, +2 | д) изменяется от –1/2 до + 1/2 |
| в) изменяется от 2 до 4 |
3-5. Измельчение твердого вещества скорость химической реакции
| а) уменьшает | в) не изменяет |
| б) увеличивает | г) замедляет |
3-6. Катализатор скорость химической реакции:
| а) не изменяет | в) уменьшает | д) периодически влияет |
| б) увеличивает | г) замедляет |
3-7. Скорость химической реакции при увеличении концентрации реагирующих веществ:
| а) уменьшается | в) не изменяется |
| б) увеличивается | г)изменяется периодически |
3-8. Скорость химической реакции зависит от
| а) температуры | в) катализатора |
| б) цвета вещества | г) формы реактора |
3-9. Знак минус в уравнении VХР = ±DС/Dt выбирают в том случае, если скорость реакции вычисляют
а) по изменению концентрации исходного вещества
б) по изменению концентрации продукта реакции
в) по изменению площади поверхности реагирующих веществ
г) по изменению температуры при протекании реакции
3-10. Порядок реакции – это сумма показателей степеней в
| а) уравнении Аррениуса | в) выражении закона действующих масс |
| б) уравнении Вант-Гоффа | г) выражении Больцмана |
3-11. Константа скорости химической реакции равна скорости химической реакции при
а) стандартной температуре
б) стандартных концентрациях реагирующих веществ
в) условии необратимости процесса
г) стандартном давлении и температуре
д) стандартном изменении энергии Гиббса
3-12. Катализатор изменяет скорость реакции, потому что
а) удаляет продукты реакции
б) взаимодействует с реагирующими веществами, изменяя энергию активации
в) изменяет температурный коэффициент реакции
г) смещает положение равновесия в сторону прямой реакции
3-13. Скорость обратной химической реакции CaCO3(Т) D CaO(Т) + CO2(Г)
описывается уравнением:
а) 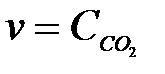
| в) 
| д) 
|
б) 
| г) 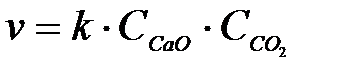
|
3-14. Температурный коэффициент показывает:
а) во сколько раз изменится скорость реакции при повышении температуры на 10˚
б) во сколько раз изменяется концентрация при повышении температуры на 10˚
в) во сколько раз увеличивается время протекании реакции при повышении температуры на 10˚
г) на сколько градусов изменяется температура при протекании реакции
3-15. Активные молекулы обладают
а) избыточной энергией
б) оптимальной ориентацией в пространстве
в) большой вероятностью столкновения
г) способностью ускорять реакцию
3-16. Константа скорости реакции 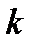 зависит от
зависит от
| а) температуры | г) концентрации продуктов реакции |
| б) давления | д) присутствия ингибиторов |
| в) концентрации исходных веществ | е) присутствия катализаторов |
3-17. Константа скорости реакции PCl3(Г) + Cl2(Г) D PCl5(Г) изменится при
| а) увеличении давления в 2 раза | г) повышении температуры |
| б) уменьшении объема в 2 раза | д) увеличении перемешивания |
| в) увеличении концентрации PCl3 |
3-18. Соответствие понятий и математических зависимостей, которые им соответствуют:
| 1) | Закон действующих масс | а) | 
|
| 2) | Уравнение Вант-Гоффа | б) | 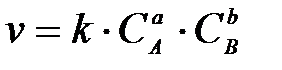
|
| 3) | Уравнение Аррениуса | в) | 
|
| г) | 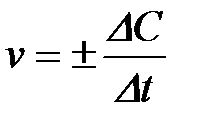
| ||
| д) | 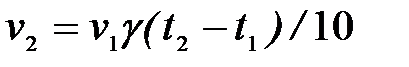
|
3-19. Предэкспоненциальный множитель в уравнении Аррениуса
а) показывает долю активных столкновений
б) равен константе скорости реакции при стандартных условиях
в) равен максимально возможной константе скорости при данной температуре
г) равен энергии активации
3-20. Закон действующих масс строго соблюдается для ___ реакций
| а) гетерогенных | в) параллельных |
| б) последовательных | г) гомогенных |
3-21. Выражение для скорости  соответствует реакции
соответствует реакции
| а) A + B " C | в) A + 2B " C | д) A2B " C + D |
| б) 2A + B " C | г) 2A + 2B " 2C |
3-22. Скорость прямой реакции CO2(Г) + СТВ " 2CO(Г) ___, если увеличить давление в 2 раза.
| а) увеличится в 4 раза | в) увеличится в 2 раза |
| б) увеличится в 16 раз | г) уменьшится в 2 раза |
3-23. Скорость обратной реакции CO2(Г) + СТВ " 2CO(Г) ___, если увеличить давление в 2 раза.
| а) увеличится в 4 раза | в) увеличится в 2 раза |
| б) Увеличится в 16 раз | г) уменьшится в 2 раза |
3-24. Температуру надо ___, для того чтобы скорость реакции
CO2(Г) + СТВ " 2CO(Г) увеличилась в 32 раза (температурный коэффициент 2).
| а) повысить на 32˚ | г) повысить на 50˚ |
| б) повысить в 32 раза | д) повысить на 100˚ |
| в) повысить на 64˚ |
3-25. Скорость реакции N2 + 3H2 " 2NH3 ___, если концентрацию азота увеличить в 4 раза и концентрацию водорода – в 2 раза.
| а) возрастает в 32 раза | в) увеличивается в 20 раз |
| б) увеличивается в 24 раза | г) возрастает в 8 раз |
3-26. Скорость реакции 4HCl(Г) + O2(Г) " 2Cl2(Г) + 2H2O(Г) ___ при увеличении давления в 3 раза.
| а) увеличится в 3 раза | в) увеличится в 243 раза |
| б) возрастет в 81 раз | г) не изменится |
_*_ _*_ _*_
3-27. Если температурный коэффициент химической реакции равен 2, тогда при повышении температуры от 20 ˚C до 50 ˚C скорость реакции
| а) уменьшается в 2 раза | в) увеличивается в 8 раз |
| б) уменьшается в 4 раза | г) увеличивается в 6 раз |
3-28. При увеличении давления в системе в 3 раза скорость химической реакции 2NO(Г) + O2(Г) D 2NO(Г)
| а) увеличится в 9 раз | в) не изменится |
| б) увеличится в 27 раз | г) уменьшится в 27 раз |
3-29. Увеличение скорости химической реакции при введении катализатора происходит в результате уменьшения
| а) теплового эффекта | в) энергии активации |
| б) энергии столкновения | г) скорости движения частиц |
3-30. Для увеличения скорости реакции 2SO2(Г) + O2(Г) D 2SO3(Г) в 9 раз необходимо концентрацию SO2 увеличить в ___ раз.
| а) 9 | б) 4,5 | в) 3 | г) 18 |
3-31. При увеличении концентрации угарного газа в 10 раз, скорость реакции
2CO(Г) + O2(Г) D 2CO2(Г) возрастает в ____ раз.
| а) 50 | б) 100 | в) 10 | г) 20 |
3-32. Положение, выражающее влияние концентрации реагирующих веществ на скорость химической реакции, называется законом
| а) Гесса | в) действующих масс |
| б) Аррениуса | г) Вант-Гоффа |
3-33. При увеличении концентрации водорода в 2 раза скорость реакции
N2(Г) + 3H2(Г) D 2NH3(Г) возрастает в ____ раз.
| а) 4 | б) 2 | в) 8 | г) 6 |
3-34. Скорость процесса увеличилась в 9 раз при повышении температуры на 20˚С. Температурный коэффициент реакции равен
| а) 2 | б) 4,5 | в) 4 | г) 3 |
3-35. При увеличении давления в 5 раз скорость химической реакции
CO(Г) + Cl2(Г) D COCl2(Г)
| а) не изменяется | в) увеличивается в 15 раз |
| б) увеличивается в 25 раз | г) увеличивается в 10 раз |
3-36. Температурный коэффициент скорости химической реакции равен 2. При охлаждении системы от 100 ˚С до 80 ˚С скорость реакции
| а) увеличивается в 4 раза | в) уменьшается в 2 раза |
| б) уменьшается в 4 раза | г) увеличивается в 2 раза |
3-37. Минимальный запас энергии частиц в момент столкновения, необходимый для протекания химической реакции, называется
| а) тепловым эффектом | в) энергией ионизации |
| б) энтальпией реакции | г) энергией активации |
3-38. При увеличении давления в 10 раз скорость реакции
H2(Г) + Br2(Г) D 2HBr(Г) увеличится в ___ раз.
| а) 20 | б) 50 | в) 10 | г) 100 |
3-39. Если температурный коэффициент химической реакции равен 2, то для увеличения скорости в 8 раз температуру необходимо увеличить на ___ градусов.
| а) 40 | б) 80 | в) 20 | г) 30 |
3-40. При увеличении давления в 2 раза скорость реакции
2SO2(Г) + O2(Г) D 2SO3(Г) увеличивается в ___ раз.
| а) 6 | б) 4 | в) 8 | г) 2 |
3-41. Для увеличения скорости химической реакции
2NO2(Г) + O2(Г) D 2NO2(Г) в 1000 раз, необходимо увеличить давление в ____ раз.
| а) 100 | б) 330 | в) 10 | г) 500 |
3-42. Если скорость реакции увеличилась в 27 раз при повышении температуры на 30 ˚С, то температурный коэффициент равен
| а) 9 | б) 2,7 | в) 2 | г) 3 |
3-43. Если при увеличении температуры от 20 ˚С до 50 ˚С скорость реакции увеличилась в 8 раз, то температурный коэффициент скорости равен
| а) 2 | б) 3 | в) 2,67 | г) 4 |
3-44. При увеличении концентрации водорода в 2 раза скорость прямой реакции N2(Г) + 3H2(Г) D 2NH3(Г), при условии ее элементарности возрастает в ____ раз(а).
| а) 6 | б) 2 | в) 8 | г) 12 |
3-45. При увеличении давления в 2 раза скорость прямой реакции
2SO2(Г) + O2(Г) D 2SO3(Г),
при условии ее элементарности, увеличивается в ___ раз(а).
| а) 6 | б) 8 | в) 2 | г) 3 |
3-46. Если увеличить давление в 10 раз, то скорость прямой реакции
H2(Г) + Br2(Г) D 2HBr(Г), при условии ее элементарности, увеличится в ___ раз.
| а) 5 | б) 50 | в) 100 | г) 20 |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1097; Нарушение авторских прав?; Мы поможем в написании вашей работы!