
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 2. Термодинамика и направленность химических реакций
|
|
|
|
Кислой солью не является
| а) NaH2PO4 | б) Na3PO4 | в) NaH2PO3 | г) Na2HPO4 |
1-58. Гидросульфат натрия в растворе реагирует с
| а) NaOH | б) H2SO4 | в) SO2 | г) H2O |
1-59. Молекулярному уравнению реакции 2NaOH + CO2 = Na2CO3 + H2O соответствует сокращенное ионное уравнение
| а) CO2 + 2OH– = CO32– + H2O | в) CO2 + OH– = CO32– + H+ |
| б) 2Na+ + 2OH– + CO2 = Na2CO3 + H2O | г) 2NaOH + CO2 = 2Na+ + CO32– + H2O |
1-60. При взаимодействии избытка раствора NaOH с H3PO4 образуется соль
| а) Na2HPO4 | б) Na3PO3 | в) NaH2PO4 | г) Na3PO4 |
1-61. Молекулярному уравнению реакции 2NaOH + CO2 = Na2CO3 + H2O соответствует сокращенное ионное уравнение
| 1) CO2 + 2OH- = CO32- + H2O | 3) CO2 + OH- = CO32- + H+ |
| 2) 2Na+ + 2OH- + CO2 = Na2CO3 + H2O | 4) 2NaOH + CO2 = 2Na+ + CO32- + H2O |
1-62. Водород является одним из продуктов растворения
| а) Au в царской водке | в) аммиака в воде |
| б) Zn в водном растворе HCl | г) Cu в азотной кислоте |
1-63. Кислота образуется при растворении в воде оксида
| а) SiO2 | б) CuO | в) CO | г) NO2 |
1-64. При взаимодействии 2 моль гидроксида натрия и 1 моль серной кислоты образуется ___ соль и вода.
| а) кислая | б) средняя | в) двойная | г) основанная |
1-65. Кислотными свойствами не обладает
| а) Ca(OH)2 | б) Al(OH)3 | в) B(OH)3 | г) P(OH)3 |
1-66. Кислотный характер имеет оксид, формула которого
| а) CaO | б) Al2O3 | в) CO | г) P2O5 |
1-67. Средняя соль образуется при взаимодействии
| а) 2 моль Mg(OH)2 и 1 моль HCl | в) 1 моль Cu(OH)2 и 2 моль H2SO4 |
| б) 1 моль Ba(OH)2 и 1 моль HCl | г) 1 моль Ca(OH)2 и 2 моль HCl |
1-68. Соль образуется при
а) разложении перекиси водорода
б) горении железа в хлоре
в) растворении негашеной извести в воде
г) обугливании сахара в серной кислоте
1-69. При взаимодействии 3 моль гидроксида натрия и 1 моль фосфорной кислоты образуется ____ соль и вода.
| а) основная | в) двойная |
| б) кислая | г) средняя |
1-70. Все вещества реагируют между собой в группе
| а) BaO, MgO, CuO | в) KOH, Ca(OH)2, Fe(OH)3 |
| б) SO3, CaO, Al2O3 | г) HCl, HBr, HI |
1-71. Растворы щелочей реагируют с
| а) Zn | б) Mn | в) N2 | г) C |
1-72. При взаимодействии 1 моль гидроксида кальция и 1 моль углекислого газа образуется ___ соль и вода.
| а) средняя | в) двойная |
| б) кислая | г) основная |
1-73. Выделение водорода происходит при взаимодействии металлов с
| а) H2SO4(КОНЦ.) | в) HNO3(КОНЦ.) |
| б) HCl(РАЗБ.) | г) HNO3(РАЗБ.) |
1-74. При взаимодействии 2 моль гидроксида калия и 1 моль фосфорной кислоты образуется ___ соль и вода.
| а) основная | в) кислая |
| б) средняя | г) двойная |
1-75. Взаимодействие между кислотой и основанием, в результате которого образуются соль и вода, называется реакцией
| а) гидролиза | в) этерификации |
| б) нейтрализации | г) диссоциации |
1-76. Число солей, которые могут образоваться в зависимости от соотношения реагентов при взаимодействии HNO3 и Al(OH)3, равно
| а) 1 | б) 2 | в) 3 | г) 4 |
1-77. К кислотным оксидам относится
| а) N2O2 | б) NO | в) N2O | г) N2O5 |
2-1. Стандартным условиям соответствуют:
а) Т = 273К, Р = 101325 Па, n = 1 моль
б) Т = 273К, V = 1 м3, n = 1 моль
в) t = 25˚С, p = 101325 Па, n = 1 моль
г) Т = 298˚, p = 101325 Па, n = 1 моль
2-2. Термодинамическими функциями являются:
| а) H – энтальпия | г) U – внутренняя энергия |
| б) V – объем | д) p – давление |
| в) S– энтропия |
2-3. Стандартная размерность энтальпии
| а) Дж/г | б) кДж/кг | в) кДж/м3 | г) кДж/моль | д) Дж/мольּК |
2-4. Стандартная размерность энергии Гиббса
| а) Дж/г | б) кДж/кг | в) кДж/м3 | г) кДж/моль | д) Дж/мольּК |
2-5. Уравнение 1-го закона термодинамики
| а) DHОБР = –DHРАЗЛ | в) DG = DH – TDS |
| б) Q = DU + АВНЕШ | г) H = U – pv |
2-6. Функцию «энтальпия» определяет выражение
| а) DHОБР = –DHРАЗЛ | в) DG = DH – TDS |
| б) Q = DU + АВНЕШ | г) H = U – pV |
2-7. Эндотермическим процессам отвечает неравенство:
| а) DSХР < 0 | в) DHХР > 0 | д) DUХР = 0 |
| б) DHХР < 0 | г) DHХР = 0 |
2-8. Изолированные системы
а) не обмениваются ни веществом, ни энергией с окружающей средой
б) обмениваются веществом и не обмениваются энергией
в) обмениваются и веществом, и энергией
г) обмениваются энергией и не обмениваются веществом
2-9. Открытые системы
а) не обмениваются ни веществом, ни энергией с окружающей средой
б) обмениваются веществом и не обмениваются энергией
в) обмениваются и веществом, и энергией
г) обмениваются энергией и не обмениваются веществом
2-10. Система – это группа тел, которые
а) находятся в окружающей среде
б) отделены от окружающей среды поверхностью
в) находятся во взаимодействии и мысленно или фактически обособлены от окружающей среды
г) находятся во взаимодействии, обособлены от окружающей среды и совершают работу против внешних сил
2-11. Функция состояния системы зависит от
| а) параметров состояния | в) теплоты и работы |
| б) пути процесса | г) теплоты сгорания |
2-12. Реакции, протекающие с поглощением теплоты, называются
| а) эпизодические | в) экзотермические |
| б) эндотермические | г) эзотерические |
2-13. Энтальпией образования вещества называется тепловой эффект
а) реакции образования этого вещества
б) образования сложного вещества из простых веществ
в) образования 1 моль сложного вещества из простых веществ, устойчивых при стандартных условиях
г) образования сложного вещества из простых веществ, устойчивых при обычных условиях
2-14. Энтальпией сгорания вещества называется тепловой эффект реакции
сгорания
а) 1 моль вещества с образованием оксидов в кислороде при обычных условиях
б) 1 моль вещества с образованием высших оксидов в кислороде при стандартных условиях
в) вещества
г) вещества в воздухе при обычных условиях
2-15. Изохорный процесс протекает при постоянном(ой)
| а) давлении | в) объеме |
| б) количестве вещества | г) температуре |
2-16. Изобарный процесс протекает при
| а) постоянном давлении | в) постоянном объеме |
| б) постоянном количестве вещества | г) постоянной температуре |
2-17. Тепловой эффект реакции, в соответствии с законом Гесса, зависит от
а) конечного и начального состояний системы и от пути процесса
б) конечного и начального состояний системы, но не зависит от пути проведения процесса
в) конечного и начального состояний системы и условий проведения процесса
г) условий проведения процесса, но не зависит от начального и конечного состояний системы
2-18. Теплота, подводимая к системе, расходуется на изменение внутренней энергии в
| а) изохорном процессе | в) изотермическом процессе |
| б) изобарном процессе | г) адиабатическом процессе |
2-19. Самопроизвольное протекание процесса в изолированной системе, в соответствии со 2-м законом термодинамики, сопровождается
а) возрастанием энтропии
б) уменьшением энтропии
в) увеличением энтальпии
г) неизменностью внутренней энергии
д) неизменностью энергии Гиббса
2-20. Самопроизвольное протекание процесса в неизолированной системе сопровождается
а) возрастанием энтропии
б) увеличением энергии Гиббса
в) уменьшением энергии Гиббса
г) неизменностью энергии Гиббса
д) совершением работы против внешних сил
2-21. Условием равновесия является
а) возрастание энтропии
б) увеличение энергии Гиббса
в) уменьшение энергии Гиббса
г) неизменность энергии Гиббса
д) совершение работы против внешних сил
2-22. Теплотой образования CO2 является тепловой эффект реакции
а) Na2CO3(Т) + 2HCl(Г) = 2NaCl(Т) + H2O(Ж) + CO2(Г)
б) 2CO(Г) + O2(Г) = 2CO2(Г)
в) C(Т) + O2(Г) = CO2(Г)
г) C(Т) + 2/3O3(Г) = CO2(Г)
2-23. Экзотермической является реакция
а) BaCO3(Т) = BaO(Т) + CO2(Г); DH = 258,7 кДж
б) CaCO3(Т) = CaO(Т) + CO2(Г); DH > 0
в) Ca(Т) + 0,5O2(Г) = CaO(Т); DH = –645,6 кДж
г) MgCO3(Т) = MgO(Т) + CO2(Г); DH = 101,6 кДж
2-24. Первое следствие из закона Гесса: тепловой эффект химической реакции равен
а) разности между суммой теплот образования исходных веществ и суммой теплот образования продуктов реакции
б) разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ
в) разности между суммой теплот образования продуктов реакции и суммой теплот сгорания исходных веществ
г) сумме теплот образования продуктов реакции и теплот образования исходных веществ
2-25. Второе следствие из закона Гесса: тепловой эффект химической реакции равен
а) разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции
б) разности между суммой теплот сгорания продуктов реакции и суммой теплот сгорания исходных веществ
в) разности между суммой теплот образования продуктов реакции и суммой теплот сгорания исходных вешеств
г) сумме теплот сгорания продуктов реакции и теплот сгорания исходных веществ
2-26. Изменение энтальпии реакции сгорания метана
CH4 + 2O2 = CO2 + 2H2O рассчитывается по уравнению
а) 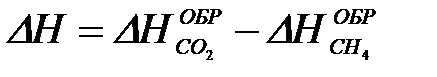
| в) 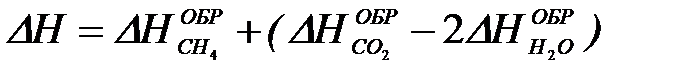
|
б) 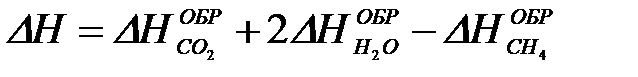
| г) 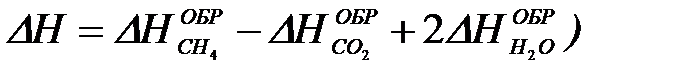
|
2-27. Изменение энтальпии при сгорании ацетилена
2C2H2 + 5O2 = 4CO2 + 2H2O рассчитывается по уравнению
а) 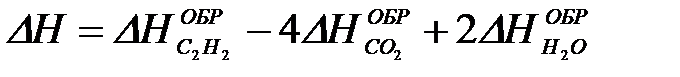
| в) 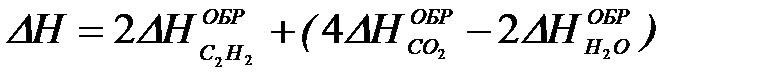
|
б) 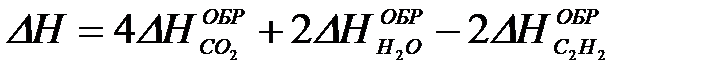
| г) 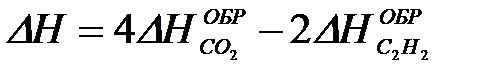
|
2-28. Энтропия при протекании реакции 4NH3(Г) + 3O2(Г) = 2N2 (Г) + 6H2O(Ж)
| а) увеличивается | в) не изменяется |
| б) уменьшается | г) зависит от условий проведения реакции |
2-29. Энтропия при протекании реакции 2SO2(Г) + O2(Г) = 2SO3(Г)
| а) увеличивается | в) не изменяется |
| б) уменьшается | г) зависит от условий проведения реакции |
2-30. Изменение энтальпии реакции:
C2H5OH(Ж) + CH3COOH(Ж) = CH3COOC2H5(Ж) + H2O(Ж)
[ 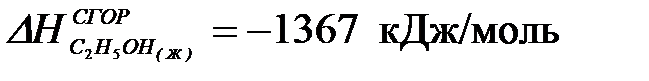 ;
; 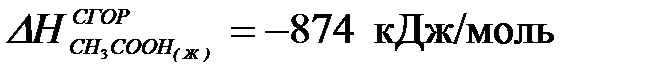 ;
;
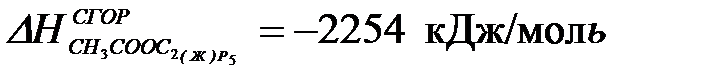 ; ]
; ]
| а) –13 кДж | б) +13 кДж | в) –26 кДж | г) +26 кДж |
2-31. Энтальпия образования HBr
2HBr(Г) = H2(Г) + Br2(Г); DH = 72,6 кДж.
| а) 72,6 кДж/моль | в) –36,3 кДж/моль |
| б) 143,2 кДж/моль | г) –72,6 кДж/моль |
2-32. Энтальпия образования HCl составляет ___ кДж/моль, если при протекании реакции H2(Г) + Cl2(Г) = 2HCl(Г) выделяется 92,31 кДж.
| а) 92,31 | б) –92,31 | в) 46,155 | г) –46,155 |
2-33. Изменение энтальпии реакции
C6H6(Ж) + 7,5O2(Г) = 6CO2(Г) + 3H2O(Г) равно:
[ 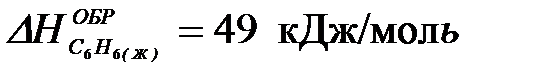 ;
; 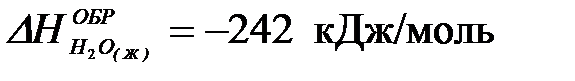 ;
; 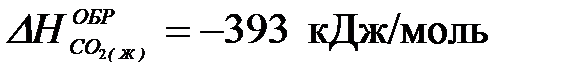 ]
]
| а) +3133 кДж/моль | в) –3133 кДж/моль |
| б) +1566,5 кДж/моль | г) –1566,5 кДж/моль |
2-34. Условие, характеризующее самопроизвольность протекания процессов в неизолированной системе:
| а) DH > 0 | в) DG = 0 | д) DG > 0 |
| б) DH = 0 | г) DG < 0 |
2-35. Условие, характеризующее самопроизвольность протекания процессов в изолированной системе:
| а) DH > 0 | б) DH = 0 | в) DS < 0 | г) DS > 0 |
2-36. Изменение энергии Гиббса при протекании химической реакции вычисляется по формуле:
а) 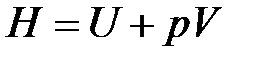
| в) 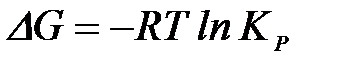
|
б) 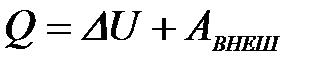
| г) 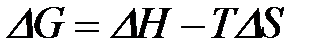
|
2-37. Формула для расчета изменения энтропии в ходе реакции:
а) 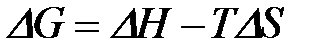
| в) 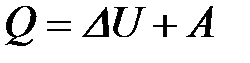
|
б) 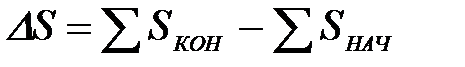
| г) 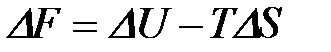
|
2-38. Самопроизвольные процессы в изолированной системе сопровождаются
| а) увеличением энтальпии | в) уменьшением энтропии |
| б) увеличением энтропии | г) уменьшением объема |
2-39. Самопроизвольные процессы в неизолированной системе сопровождаются
| а) уменьшением энергии Гиббса | в) уменьшением энтропии |
| б) увеличением энергии Гиббса | г) уменьшением объема |
2-40. Энергия Гиббса является функцией состояния, и ее изменение равно
а) сумме энергий Гиббса исходных веществ и конечных продуктов
б) разности между суммой энергий Гиббса начальных веществ и суммой энергий Гиббса конечных веществ
в) разности между суммой энергий Гиббса конечных веществ и суммой энергий Гиббса начальных веществ
г) определяется способом проведения процесса
2-41. Энтропия является функцией состояния, и ее изменение равно
а) сумме энтропий исходных веществ и конечных продуктов
б) разности между суммой энтропий начальных веществ и суммой энтропий веществ
в) разности между суммой энтропий конечных веществ и суммой энтропий начальных веществ
г) определяется способом проведения процесса
2-42. Качественно определите: энтропия при протекании реакции
N2(Г) + O2(Г) = 2NO(Г)
| а) увеличится | в) равна нулю |
| б) не изменится | г) уменьшится |
2-43. Соответствие между словами и цифрами
| Т |
| S |
| 1) | твердое | а) | |
| 2) | жидкое | б) | |
| 3) | газообразное | в) | |
| 4) | ионное |
2-44. Качественно определите изменение энтропии при протекании реакции 2C4H10(Г) + 13O2(Г) = 8CO2(Г) + 10H2O(Г)
| а) DS > 0 | б) DS < 0 | в) DS = 0 | г) DS» 0 |
2-45. Реакции, протекающие самопроизвольно в обратном направлении:
а) CH4(Г) + CO2(Г) D 2CO(Г) + 2H2(Г); DG = 170,63 кДж
б) Fe2O3(Т) + 3H2(Г) D 2Fe(Т) + 3H2O (Г), DG = 55,28 кДж
в) 4NH3(Г) + 5O2(Г) D 4NO(Г) + 6H2(Г), DG = –959,81 кДж
г) CO(Г) + Cl2(Г) D COCl2(Г), DG < 0
2-46. Самопроизвольно в системе
Fe2O3(Т) + 3H2(Г) D 2Fe(Т) + 3H2O (Г), DG = 55,28 кДж
будет протекать
| а) прямая реакция | в) прямая и обратная реакции равновероятны |
| б) обратная реакция | г) химические изменения невозможны |
2-47. Прямая реакция протекает самопроизвольно, если изменение свободной энергии Гиббса равно
| а) DGХР = –190 кДж/моль | в) DGХР = 0 кДж/моль |
| б) DGХР = +190 кДж/моль | г) DGХР = –DHХР |
2-48. Качественно определите: энтропия при протекании реакции
2C(Т) + 3H2(Г) = C2H6(Г)
| а) увеличится | в) равна нулю |
| б) не изменится | г) уменьшится |
2-49. Качественно определите: энтропия при протекании реакции
3Fe(Т) + 2CO(Г) = Fe3C(Т) + CO2(Г)
| а) уменьшится | в) не изменится |
| б) увеличится | г) равна нулю |
2-50. Изменение энтропии реакции:
2C4H10(Г) + 13O2(Г) = 8CO2(Г) + 10H2O(Г),
если SC4H10 = a, SO2 = b, SCO2 = c, SH2O = d, вычисляется по уравнению
| а) DS = 2a – 13b + 8c – 10d | в) DS = 8c + 10d – 2a – 13b |
| б) DS = 8c + 10d – a – 13b | г) DS = 2a + 13b – 8c – 10d |
_*_ _*_ _*_
2-51. Количество теплоты, выделяющее при сгорании 16 г серы, равно ___ кДж (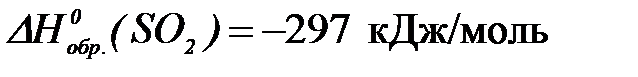 ).
).
| а) 297 кДж | б) 594 кДж | в) 74,25 кДж | г) 148,5 кДж |
2-52. Количество теплоты (кДж), выделяемое в организме при окислении 45 г глюкозы (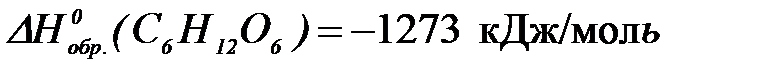 ) до углекислого газа равно (
) до углекислого газа равно (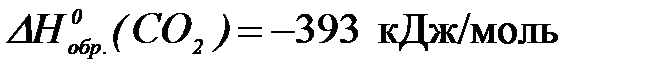 и воды (
и воды (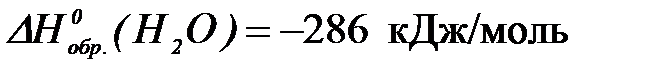 ),
),
| а) 700,25 | б) 2801 | в) 466,8 | г) 1400,5 |
2-53. В соответствии с термохимическим уравнением
FeO(Т) + H2(Г) D Fe(Т) + H2O(Г), DH0 = 23 кДж для получения 560 г железа необходимо затратить ____ кДж тепла.
| а) 115 | б) 23 | в) 230 | г) 560 |
2-54. При разложении 1 моль CaCO3 поглощается 178,5 кДж теплоты. Объем выделившегося при этом газа равен
| а) 22,4 л | б) 11,2 л | в) 5,6 л | г) 16,8 л |
2-55. При нагревании 56 г железа с 32 г серы (DH0 = –100 кДж/моль) выделяется ___ кДж теплоты.
| а) 50 кДж | б) 25 кДж | в) 100 кДж | г) 75 кДж |
2-56. При получении 2 моль этанола, согласно термохимическому уравнению C2H4(Г) + H2O (Ж) D C2H5OH(Ж), DH0 = –44 кДж, выделяется ___ кДж теплоты.
| а) 88 | б) 66 | в) 44 | г) 22 |
2-57. При взаимодействии 16 г серы и 11,2 л водорода выделяется ___ кДж теплоты (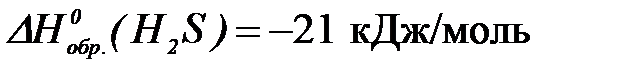 ).
).
| а) 21 | б) 5,25 | в) 42 | г) 10,5 |
2-58. Если при разложении перхлората калия, согласно термохимическому уравнению KClO4(Т) D KCl(Т) + 2O2(Г), DH0 = 33 кДж, образовалось 10 моль кислорода, то количество затраченного тепла ____ кДж.
| а) 66 | б) 330 | в) 165 | г) 132 |
2-59. В соответствии с термохимическим уравнением
CH4(Г) + 2O2(Г) = CO2(Г) + 2H2O(Г), DH0 = –802 кДж
для получения 500 кДж теплоты необходимо сжечь ____ л(н.у.) метана.
| а) 28 л | б) 42 л | в) 14 л | г) 56 л |
2-60. Для получения 1132 кДж тепла по реакции
2NO(Г) + O2(Г) D 2NO2(Г), DH0 = –566 кДж
необходимо затратить ___ литра(ов) кислорода.
| а) 22,4 | б) 11,2 | в) 44,8 | г) 56 |
2-61. В системе, находящейся при постоянных давлении и температуре, самопроизвольно могут протекать процессы, для которых
| а) DH > 0 | б) DG > 0 | в) DS < 0 | г) DG < 0 |
2-62. При переходе от кристаллического состояния вещества к газообразному его энтропия
| а) возрастает | в) изменяется хаотично |
| б) уменьшается | г) остается неизменной |
2-63. Для получения 17 г сероводорода по реакции
H2(Г) + S(Т) = H2S(Г) – 21 кДж требуется затратить ___ кДж теплоты.
| а) 11,5 | б) 32,5 | в) 42 | г) 21 |
2-64. Для получения 112 г оксида кальция по реакции
CaCO3(Т) = CaO(Т)+ CO2(Г) – 178,5 кДж требуется затратить ___ кДж теплоты.
| а) 178,5 | б) 268,8 | в) 224 | г) 357 |
2-65. Если энтальпия образования SO2 равна –297 кДж/моль, то количество теплоты, выделяемое при сгорании 16 г серы, равно ___ кДж
| 1) 74,25 | 2) 148,5 | 3) 297 | 4) 594 |
2-66. Термодинамическая функция, характеризующая степень упорядоченности состояния системы, называется
| а) энтропией | в) энтальпией |
| б) теплоемкостью | г) внутренней энергией |
2-67. Энтальпия образования H2S(Г) равна -21 кДж/моль. При взаимодействии 16 г серы и 11,2 л водорода выделяется ___ кДж теплоты.
| а) 5,25 | б) 21 | в) 10,5 | г) 42 |
2-68. В изолированной системе самопроизвольно могут протекать процессы, для которых
| а) DS < 0 | б) DS > 0 | в) DG > 0 | г) DH > 0 |
2-69. Для получения 22,4 л (н.у.) аммиака по реакции
N2(Г) + 3H2(Г) = 2NH3(Г) – 92,3 кДж требуется затратить ___ кДж теплоты.
| а) 92,3 | б) 139,8 | в) 69,9 | г) 46,6 |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1295; Нарушение авторских прав?; Мы поможем в написании вашей работы!