
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
FeSO4, NH4NO3, CuCl2, NaHCO3, (CuOH)2CO3. 2 страница
|
|
|
|
Ответ: а, в.
Д19. Анодный процесс, протекающий при коррозии железных пластин, скрепленных алюминиевыми заклепками, во влажном воздухе, описывается уравнением:
| а) Al0 – 3e = Al3+ | г) Fe0 – 2e = Fe2+ |
| б) O2 + 2H2O + 4e = 4OH– | д) Fe2+ + 2e = Fe0 |
| в) Al3+ + 3e = Al0 | е) O2 + 4e = 2O2– |
При контакте двух металлов более активный из них окисляется (разрушается) и является анодом, а на менее активном (катоде) происходит процесс восстановления окислителя. По величинам стандартных электродных потенциалов определяем: алюминий более активный металл, чем железо ( ) < (
) < (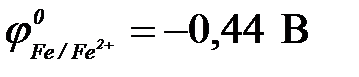 ), и будет анодом.
), и будет анодом.
Электронные уравнения процессов:
А) Al0 – 3  = Al3+ = Al3+
| ּ4 | |
К) O02 + 2H2O + 4  = 4OH– = 4OH–
| ּ3 |
4Al0 + 3O02 + 6H2O = 4Al3+ + 12OH–
Молекулярное уравнения:
Первичный процесс коррозии: 4Al + 3O2 + 6H2O = 4Al(OH)3
Вторичный процесс, протекающий при коррозии: гидроксид алюминия разлагается с выделением H2O
2Al(OH)3 3H2O + Al2O3
Ответ: а).
Тема 1. Классы неорганических соединений
1-1. Хлороводородная кислота
| а) HCl | б) HClO | в) HClO3 | г) HClO4 |
1-2. Серная кислота
| а) H2S | в) H2SO4 | д) H2S2O7 |
| б) H2SO3 | г) H2S2O3 |
1-3. Азотная кислота
| а) HN3 | б) NH3 | в) HNO2 | г) HNO3 |
1-4. Ортофосфорная кислота
| а) HPO3 | б) H3PO4 | в) H4P2O7 | г) H3PO3 |
1-5. Гидроксид натрия
| а) NaH | б) NaOH | в) NaHCO3 | г) Na2CO3 |
1-6. Сернистая кислота
| а) H2S | в) H2SO4 | д) H2S2O7 |
| б) H2SO3 | г) H2S2O3 |
1-7. Сероводородная кислота
| а) H2S | в) H2SO4 | д) H2S2O7 |
| б) H2SO3 | г) H2S2O3 |
1-8. Метафосфорная кислота
| а) HPO3 | б) H3PO4 | в) H4P2O7 | г) H3PO3 |
1-9. Двухосновными кислотами являются
| а) H2S2O7 | г) NaHCO3 | ж) HClO4 |
| б) NaOH | д) Cu(OH2 | з) HPO3 |
| в) K2CO3 | е) H2S | и) CuOHCl |
1-10. Бескислородными кислотами являются
| а) H2S2O7 | г) NaHCO3 | ж) HCl |
| б) NaOH | д) Cu(OH)2 | з) HPO3 |
| в) K2CO3 | е) H2S | и) CuOHCl |
1-11. Солями являются
| а) H2S2O7 | г) NaHCO3 | ж) HClO4 |
| б) NaOH | д) Cu(OH)2 | з) HPO3 |
| в) K2CO3 | е) H2S | и) CuOHCl |
1-12. Кислые соли –
| а) H2S2O7 | г) NaHCO3 | ж) HClO4 |
| б) NaOH | д) Cu(OH)2 | з) HPO3 |
| в) K2CO3 | е) Ca(HS)2 | и) CuOHCl |
1-13. Основные соли –
| а) Fe(OH)2NO3 | г) NaHCO3 | ж) HClO4 |
| б) NaOH | д) Cu(OH)2 | з) HPO3 |
| в) K2CO3 | е) Ca(HS)2 | и) CuOHCl |
1-14. Основания –
| а) Fe(OH)2NO3 | г) NaHCO3 | ж) Cu(OH)2 |
| б) NaOH | д) HClO4 | з) HPO3 |
| в) K2CO3 | е) Ca(HS)2 | и) CuOHCl |
1-15. Щелочи –
| а) Fe(OH)2NO3 | г) NaHCO3 | ж) Al(OH)3 |
| б) NaOH | д) Cu(OH)2 | з) HPO3 |
| в) KOH | е) Ba(OH)2 | и) CuOHCl |
1-16. Соответствие между названием вещества и его формулой:
| 1) | Ортофосфорная кислота | а) | Fe(OH)3 |
| 2) | Карбонат натрия | б) | HPO3 |
| 3) | Гидроксид железа (II) | в) | NaHCO3 |
| 4) | Гидрокарбонат натрия | г) | Na2CO3 |
| д) | H3PO4 | ||
| е) | Fe(OH)2 |
1-17. Соответствие между формулой вещества и его названием:
| 1) | Na2SO4 | а) | серная кислота |
| 2) | H2SO4 | б) | сернистая кислота |
| 3) | NaHCO3 | в) | сульфат натрия |
| г) | карбонат натрия | ||
| д) | гидрокарбонат натрия |
1-18. Реакцией нейтрализации будет:
а) Na2O + 2HNO3 " 2NaNO3 + H2O
б) NaOH + HNO3 " NaNO3 + H2O
в) Na2CO3 + HNO3 " 2NaNO3 + CO2# + H2O
г) Na2CO3 + Ca(NO3)2 " 2NaNO3 + CaCO3$
1-19. Формулы кислотных оксидов:
| а) CaO | в) CO2 | д) Na2O |
| б) SiO2 | г) Fe2O3 | е) NO2 |
1-20. Щелочи –
| а) NaOH | в) LiOH | д) Ba(OH)2 |
| б) Ni(OH)2 | г) Fe(OH)2 | е) Co(OH)2 |
1-21. Бескислородные кислоты –
| а) HF | в) H3PO4 | д) HBr |
| б) H2SO4 | г) HCN | е) H3BO3 |
1-22. Амфотерными называются соединения, которые способны реагировать
| а) только с кислотами | в) и с кислотами, и со щелочами |
| б) только со щелочами | г) и с кислотами, и с гидроксидами |
1-23. Химические соединения NaNO3, KCl, CaCO3 относятся к
| а) основным оксидам | в) кислородосодержащим кислотам |
| б) средним солям | г) основаниям |
1-24. Соответствие оксидов и кислот:
| 1) | SO3 | а) | H2SO3 |
| 2) | P2O5 | б) | H3PO4 |
| 3) | CO2 | в) | H2S2O3 |
| 4) | SO2 | г) | H2CO3 |
| д) | H2SO4 |
1-25. Соответствие формул солей и названий:
| 1) | Na2CO3 | а) | сульфид аммония |
| 2) | KCl | б) | гидрокарбонат натрия |
| 3) | LiNO3 | в) | нитрат лития |
| 4) | (NH4)2SO4 | г) | карбонат натрия |
| д) | хлорид калия | ||
| е) | сульфат аммония |
1-26. Неэлектролитами являются
| а) SO3 | г) NaHCO3 | ж) HClO4 |
| б) NaOH | д) CuO | з) HPO3 |
| в) K2CO3 | е) Fe2O3 | и) CuOHCl |
1-27. Электролитами являются
| а) SO3 | г) NaHCO3 | ж) HClO4 |
| б) KOH | д) CuO | з) HPO3 |
| в) CO2 | е) Fe2O3 | и) N2 |
1-28. Уравнение полной диссоциации H3PO4
| а) H3PO4 D H+ + HPO4– | в) H3PO4 D 3H+ + PO43– |
| б) H3PO4 D 2H+ + HPO42– | г) H3PO4 D 3H+ + PO42– |
1-29. Уравнение реакции нейтрализации
а) 2NaOH + K2SO4 = Na2SO4 + 2KOH
б) CoCl2 + 2NaOH = 2NaCl + Co(OH)2
в) H2SO4 + 2NaOH = Na2SO4 + 2H2O
г) 2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
1-30. Амфотерное соединение
| а) Ca(OH)2 | б) H2SO4 | в) Zn(OH)2 | г) Cu(OH)Cl |
1-31. Формулы основных солей:
| а) CaOHCl | б) ZnCl2 | в) Al(OH)2NO3 | г) KHSO4 |
1-32. Молекулярному уравнению реакции
KCl + AgNO3 = AgCl $+ KNO3 соответствует сокращенное ионное уравнение:
а) K+ + NO3– = KNO3
б) Cl– + Ag+ = AgCl
в) K+ + 3NO– = KNO3
г) K+ + Cl– + Ag+ + NO3– = AgCl$ + K+ + NO3–
1-33. Молекулярному уравнению реакции CuO + 2HNO3 = Cu(NO3)2 + H2O
соответствует сокращенное ионное уравнение:
а) CuO + 2HNO3 = Cu2+ + 2NO3– + H2O
б) CuO + 2H+ + 2NO3– = Cu2+ + 2NO3– + H2O
в) CuO + 2H+ = Cu2+ + H2O
г) Cu2+ + O2– + 2H+ = Сu2+ + H2O
д) O2– + 2H+ = H2O
1-34. Молекулярному уравнению реакции Zn(OH)2$ + H2SO4 = ZnSO4 + 2H2O соответствует сокращенное ионное уравнение:
а) Zn(OH)2 + 2H+ + 4SO2– = Zn2+ + SO42– + 2H2O
б) Zn2+ + 2OH– + 2H+ + SO42– = Zn2+ + SO42– + 2H2O
в) Zn 2++ 2OH– + H2SO4 = ZnSO4 + 2H2O
г) Zn(OH)2 + 2H+ = Zn2+ + 2H2O
1-35. Сумма коэффициентов в сокращенном ионном уравнении реакции Zn(OH)2$ + H2SO4 = ZnSO4 + 2H2O равна
| а) 10 | б) 7 | в) 6 | г) 11 |
1-36. Сумма коэффициентов в сокращенном ионном уравнении реакции
CuO + 2HNO3 = Cu(NO3)2 + H2O
| а) 5 | б) 6 | в) 7 | г) 9 |
1-37. Сумма коэффициентов в сокращенном ионном уравнении реакции
Na2CO3 + 2HNO3 = 2NaNO3 + CO2# + H2O
| а) 3 | б) 5 | в) 7 | г) 9 |
1-38. Соединения, принимающие участие в процессе
FeS$ + 2HCl = FeCl2 + H2S, которые в ионном уравнении реакции записываются в молекулярном виде:
| а) FeS$ и HCl | в) HCl и H2S | д) FeS$ и H2S |
| б) FeS$, FeCl2 и H2S | г) FeC$, HCl и H2S |
1-39. Соединения, принимающие участие в процессе
CaCO3$ + 2HNO3 = Ca(NO3)2 + CO2# + H2O, которые в ионном уравнении реакции записываются в молекулярном виде:
| а) CaCO3$, HNO3, Ca(NO3)2 и CO2# | в) CaCO3$, HNO3 CO2#, H2O |
| б) CaCO3$, Ca(NO3)2, CO2# H2O, HNO3 | г) CaCO3$, CO2# и H2O |
1-40. Сумма коэффициентов в полном ионном уравнении, соответствующем реакции Ca(NO3)2 + Na2CO3 = CaCO3$ + 2NaNO3:
| а) 12 | б) 11 | в) 10 | г) 9 |
1-41. Сумма коэффициентов в сокращенном ионном уравнении, соответствующем реакции CO2 + 2NaOH = Na2CO3 + H2O:
| а) 11 | б) 10 | в) 9 | г) 5 | д) 4 |
1-42. Сумма коэффициентов в полном ионном уравнении, соответствующем реакции CO2 + 2NaOH = Na2CO3 + H2O:
| а) 11 | б) 10 | в) 9 | г) 5 |
1-43. Реакции нейтрализации соответствует сокращенное ионное уравнение:
| а) H+ + OH– = H2O | г) 2H+ + CO32– = H2O + CO2 |
| б) Co2+ + 2OH– = Co(OH)2 | д) 3H+ + 3OH– = 3H2O |
| в) Ag+ + Cl– = AgCl |
_*_ _*_ _*_
1-44. Уравнение реакции, практически осуществимой в водном растворе, имеет вид:
а) NaNO3 + HCl =NaCl +HNO3
б) Ba(NO3)2 +2NaOH = 2NaNO3 +Ba(OH)2
в) CuSO4 + 2KOH = K2SO4 +Cu(OH)2
г) Fe2(SO4)3 + 6HNO3 = 2Fe(NO3)3 + 3H2SO4
1-45. Уравнение реакции, которая в водном растворе протекает до конца:
а) K2SO4 + 2HCl = H2SO4 + 2KCl
б) BaSO4 + 2HCl = BaCl2 + H2SO4
в) CaCl2 + 2NaNO3 = Ca(NO3)2 + 2NaCl
г) FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
1-46. Средняя соль образуется при взаимодействии:
а) 1 моль NaOH и 1 моль H2SO4
б) 1 моль Ca(OH)2 и 2 моль HCl
в) 2 моль Mg(OH)2 и 1 моль HCl
г) 1 моль Cu(OH)2 и 2 моль H2SO4
1-47. Кислая соль образуется при взаимодействии 1 моль Ca(OH)2 c
| а) 1 моль CH3COOH | в) 1 моль H2SO4 |
| б) 1 моль H3PO4 | г) 5 моль HCl |
1-48. Образование осадка наблюдается при сливании растворов:
| а) CuSO4 и KOH | в) CuSO4 и HNO3 |
| б) NaOH и H2SO4 | г) K2CO3 и HNO3 |
1-49. При взаимодействии оксида серы(IV) с избытком раствора NaOH образуется:
| а) сульфат натрия и вода | в) гидросульфит натрия |
| б) сульфит натрия и вода | г) гидросульфат натрия |
1-50. Кислота образуется при растворении в воде оксида:
| а) P2O5 | б) K2O | в) SiO2 | г) N2O |
1-51. При взаимодействии оксида азота (IV) с раствором NaOH образуются:
| а) NaNO2, HNO3 и H2O | в) NaNO2, NaNO3 и H2O |
| б) NaNO2, N2O5 и H2O | г) NaNO3, HNO2 и H2O |
1-52. Сокращенное ионное уравнение Ba2+ + SO42– = BaSO4 соответствует реакции:
| а) Ba(NO3)2 + SO2 " | б) BaCl2 + Na2SO4 " |
| в) BaCO3 + H2SO4 " | г) Ba3(PO4)2 + H2SO4 " |
1-53. Сокращенное ионное уравнение H+ + OH– = H2O соответствует реакции:
| а) KOH + H2SO4 " | б) Fe(OH)2 + H2SO4 " |
| в) NH4OH + H2SO4 " | г) Ba(OH)2 + H2SO4 " |
1-54. К кислотным оксидам относится:
| а) NH2O2 | б) N2O | в) N2O5 | г) NO |
1-55. Оксид цинка не реагирует с
| а) Na2O | б) SO2 | в) NO | г) CO2 |
1-56. При взаимодействии Al(OH)3 с избытком HCl образуется соль, формула которой
| а) Al(OH)2Cl | б) AlHCl2 | в) Al(OH)Cl2 | г) AlCl3 |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1182; Нарушение авторских прав?; Мы поможем в написании вашей работы!