
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 1. 2
|
|
|
|
ФАЗОВА РІВНОВАГА ТА ВЧЕННЯ ПРО РОЗЧИНИ
ПЛАН:
- Загальна характеристика розчинів.
- Розчини газів в рідинах. Закон Генрі.
- Розчинність твердих речовин в рідинах.
- Дифузія і осмос в розчинах. Закон Вант-Гоффа.
- Тиск пари над розчинами. Закон Рауля.
- Температура кристалізації і кипіння розчинів.
- Фазові переходи. Фазова рівновага.
ВИВЧИВШИ ТЕМУ, ВИ ПОВИННІ:
Знати:
P визначення “розчини”, “фази”, “фазовий перехід”;
P правило фаз Гіббса;
P однокомпонентні системи, діаграма стану води;
P види розчинів;
P способи виразу концентрації розчинів;
P явища дифузії і осмосу, закон Вант-Гоффа;
P правила приготування розчинів. Закон Генрі;
P особливості поведінки розчинів;
P тиск насиченої пари над розчином;
P температури кристалізації та кипіння розчинів;
P закон Рауля.
Вміти:
P розраховувати число ступенів свободи за правилом Гіббса;
P визначати розчинність газів за законом Генрі;
P розрахувати потрібні величини за законом Рауля;
P визначати DТзам. та DТкип.в залежності від концентрації розчину;
P працювати з діаграмою стану води.
1. ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОЗЧИНІВ
Розчини – одна з найважливіших фізико-хімічних систем. Розробка теорії розчинів відіграла важливу роль у розвитку фізичної хімії. Ще М.В.Ломоносов звернув увагу на важливість розчинів для розвитку хімічних наук. Важливість розчинів визначається перш за все їх поширеністю. Переважна більшість біологічних процесів відбувається в розчинах.
Розчинами називають багатокомпонентні гомогенні системи, в яких одна або кілька речовин розподілені у вигляді молекул, атомів або іонів в середовищі іншої речовини – розчинника.
До розчинів відносяться суміші газів, розчини різних речовин в рідинах та тверді розчини. Найбільш розповсюджені рідкі розчини. Прикладами рідких розчинів є розчини солей, спирту, кислот у воді; твердих - сплави. Газоподібним є повітря.
У рідких розчинах один із компонентів називають розчиненою речовиною, другий - розчинником.
Розчинник – це рідкий компонент розчину, який береться у надлишку порівняно з іншими компонентами.
У сучасній теорії розчинів визначається важливість як фізичних, так і хімічних сил між молекулами (атомами, іонами) у розчині.
Гомогенність розчинів обумовлена тим, що під час їх утворення, внаслідок взаємодії з розчинником, розчинена речовина подрібнюється до молекул або йонів, тобто розміри часток розчиненої речовини, розподілених між молекулами розчинника, не перевищують 10-9м. Такі розчини називають істинними.
Розчини, в яких частки розчиненої речовини мають розмір від і10-9м до 10- 7м є колоїдними, а більше 10-7м - грубодисперсними.
Істинні розчини прозорі, легко проходять через фільтр.
Розчин утворюється зі складових частин (компонентів) самодовільно, тому його утворення при сталих Р та Т пов’язане зі зменшенням ізобарного потенціалу (вільної енергії) системи. Ізобарний потенціал залежить не тільки від температури і тиску, а й від складу розчину, тобто від кількості компонента в розчині. Це твердження справджується також для інших термодинамічних потенціалів.
Найважливішою характеристикою розчину є його склад або концентрація компонентів.
Концентрація розчину – це кількість розчиненої речовини, що міститься в певній кількості розчинника або розчину.
Розчини з високою концентрацією розчиненої речовини називаються концентрованими, з низькою – розбавленими.
Кількісний склад розчинів в фізичній хімії часто виражають через молярну і моляльну концентрацію, молярні і масові частки.
Молярна концентрація – це відношення кількості розчиненої речовини до об’єму розчину.
В СІ кількість речовини вимірюють в молях, тому одиницею молярної концентрації в СІ є моль/м3 або моль/л.
С = n/V або С = m/(М∙V)
де п - кількість речовини в молях;
V— об'єм розчину;
т - маса розчиненої речовини;
М- молярна маса.
Наведемо приклади назв розчинів різної молярної концентрації, моль/л:
1,000 (1М) – молярний;
2,000 (2М) – двомолярний;
0,100 (0,1М) – децимолярний;
0,200 (0,2М) – дводецимолярний;
0,030 (0,03М) – трисантимолярний;
0,004 (0,004М) – чотиримілімолярний.
Моляльна концентрація – це відношення кількості розчиненої речовини до маси розчинника.
Її вимірюють в моль/кг. Числове значення моляльної концентрації, позначають Сm:
Сm = (n ∙ 1000) / m (розчинника)
де
п - кількість молів розчиненої речовини;
т - маса розчинника.
ð Еквівалентна концентрація (або нормальність) Сн - визначається числом молярних мас еквівалентів розчиненої речовини в 1л розчину:
Сн = m / Em ∙ V,
де т - маса розчиненої речовини;
Em - еквівалентна маса;
V - об'єм розчину.
Еквівалентну концентрацію за останніми рекомендаціями називають молярною концентрацією еквіваленту.
Молярна частка – це відношення числа молей одного з компонентів розчину до загального числа молей всіх компонентів. Її виражають в долях одиниці або у відсотках (%). Молярна частка N1 одного компоненту розчину визначається по формулі:
N1 = 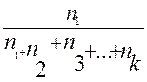
Де n1 – число молів цього компонента в розчині;
n2,n3,….nк - число молів інших компонентів.
Сума мольних часток всіх компонентів розчину дорівнює 1 або 100%.
N1 + N2 +....Nк = 1
Масова частка – це відношення маси розчиненої речовини до маси розчину. Її також виражають в частках одиниці або у відсотках (%).
2. РОЗЧИНИ ГАЗІВ В РІДИНАХ. ЗАКОН ГЕНРІ
Розчинність газів в рідинах значною мірою залежить від природи газу і розчинника, від Т і Р. Якщо між газом і розчинником немає хімічної взаємодії, то концентрація газу в розчині невелика.
Наприклад, за нормальних умов в 1 л води розчиняється 0,002г Н2. Також мало розчиняється у воді N2. Розчинність О2 у воді приблизно в 2 рази вища, ніж N2, тому повітря, розчинене у воді, більше багате на О2, ніж повітря атмосфери.
Деякі гази, наприклад, аміак, взаємодіють з водою і розчинність їх у воді велика (8,75г NH3 в 1л Н2О).
Залежність розчинності газів від тиску визначається законом Генрі (англійський хімік). Згідно цього закону:
Розчинність газу при постійній температурі прямо пропорційна тиску газу над розчином:
С = К ∙ р;
де С – концентрація газу в розчині;
К - коефіцієнт пропорційності, що залежить від природи рідини і газу;
р - тиск газу над розчином.
Закон Генрі справджується тільки для розбавлених розчинів в умовах низьких тисків. Для суміші газів розчинність кожного з них пропорційна його парціальному тиску.
Гази, що вступають у взаємодію з розчинником (напр.NH3, SO2, НСl), закону Генрі не підкоряються. Їх розчинність також збільшується з підвищенням Р, але по більш складнішому закону.
Пониження тиску над розчином веде до зменшення розчинності газів і виділення його з рідини у вигляді пухирців. Прикладом можуть служити різні газовані напої, в яких при великому Р розчиняють СО2. При відкриванні пляшки з такою водою тиск над рідиною різко знижується і розчинений СО2 інтенсивно виділяється.
Зміною розчинності газів при різкому зниженні тиску пояснюється так звана кесонна хвороба. На великих глибинах водолаз дихає повітрям, що знаходиться під великим тиском. При таких тисках розчинність газів у крові відповідно до закону Генрі збільшується. На глибині 40м нижче рівня моря загальний тиск становить 600кПа і розчинність азоту в плазмі крові в 9 разів більше ніж на поверхні моря. При швидкому підніманні водолаза, що супроводжується різким зменшенням тиску, гази, розчинені в крові, починають бурно виділятися. Пухирці газу закупорюють судини, що й є причиною кесонної хвороби і може привести до тяжких наслідків.
Розчинність газів майже завжди протікає з виділенням теплоти.
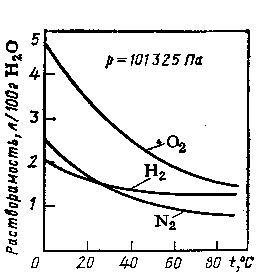 З підвищенням температури рівновага зміщується в сторону ендотермічного процесу і розчинність газів зменшується (рис.4); з пониженням температури розчинність газів збільшується. Тривалим кип’ятінням можна майже повністю видалити розчинені гази з рідини, а насичення рідин газом доцільніше проводити при низьких температурах.
З підвищенням температури рівновага зміщується в сторону ендотермічного процесу і розчинність газів зменшується (рис.4); з пониженням температури розчинність газів збільшується. Тривалим кип’ятінням можна майже повністю видалити розчинені гази з рідини, а насичення рідин газом доцільніше проводити при низьких температурах.
Рис.4. Залежність розчинності газів у воді від температури
Таблиця 1.5
Розчинність газів у воді при різних температурах, м3 газу/м3 води
| Температура, К | Г а з | ||||
| О2 | Н2 | СО2 | Н2S | SO2 | |
| 0,049 | 0,022 | 1,71 | 4,76 | 79,8 | |
| 0,031 | 0,018 | 0,88 | 2,58 | 39,4 | |
| 0,021 | 0,017 | 0,53 | 1,66 | 18,8 | |
| 0,010 | 0,016 | 0,36 | 1,19 | 10,6 |
Розчинність газів зменшується при наявності в розчині третього компонента. Так, в розчинах електролітів гази розчиняються значно гірше, ніж в чистій воді. Так, наприклад, при 20оС і 101,3 кПа в 1л води розчиняється 6,7г Сl2 , а в 26% розчині NaCl розчиняється 0,9г Сl2. Тому при зберіганні Сl2 над рідиною заміняють воду на розчин NaCl. Зменшують розчинність газів у воді й різні неелектроліти.
3. РОЗЧИННІСТЬ ТВЕРДИХ РЕЧОВИН В РІДИНАХ
Процес розчинення твердих речовин у рідинах складається із руйнування кристалічної гратки і дифузії речовин в об’єм. При цьому під впливом розчинника, від поверхні твердих речовин поступово відриваються окремі молекули або йони і рівномірно розподіляються по всьому об’єму розчину.
Розчинність твердих речовин в рідинах визначається природою розчинника і розчиненої речовини, а також температурою. При розчиненні твердої речовини в рідині досягається концентрація, при якій тверда речовина перестає розчинятися і встановлюється рівновага між розчином і твердою речовиною. Такий розчин називають насиченим.
Концентрація насиченого розчину будь-якої речовини при даній температурі постійна і характеризує розчинність цієї речовини.
При певних умовах можна одержати розчини, концентрація яких вища концентрації насиченого розчину. Такі розчини називаються перенасиченими.
Розчин називається перенасиченим, коли в ньому міститься значно більше розчиненої речовини, ніж її потрібно для насичення при даній температурі.
Вони досить нестійкі і при перемішуванні, струшуванні або попаданні них твердих частинок (пил тощо) розділяються на осад розчиненої речовини і насичений розчин. У спокійному стані вони можуть роками залишатися без змін.
Швидкість розчинення твердої речовини залежить від розміру частинок – великі шматки твердої речовини слід подрібнювати в ступці. Проте гігроскопічні речовини не подрібнюють перед розчиненням. Якщо порошок при висипанні у воду спливає і не змочується, то його слід спочатку змочити етиловим спиртом, а потім додавати у воду. Смолисті речовини перед розчиненням слід розрізати на невеликі шматочки і вводити до розчинника поступово.
Розчинення твердих речовин супроводжується поглинанням або виділенням теплоти, яку відносять до 1молю розчиненої речовини. Різниця в знаках теплового ефекту розчинення пояснюється тим, що при розчиненні твердих речовин в рідині одночасно йдуть два процеси – взаємодія молекул розчинника з молекулами або іонами твердої речовини (сольватація) або при розчиненні у воді (гідратація) та руйнування твердої речовини з розподіленням її по всьому об’єму розчину. При сольватації енергія виділяється (ΔН1< 0), на руйнування твердої речовини енергія витрачається (ΔН2 > 0). Сумарний тепловий ефект залежить від абсолютних значень ΔН1 та ΔН2 і може бути як позитивний, так і від’ємним.
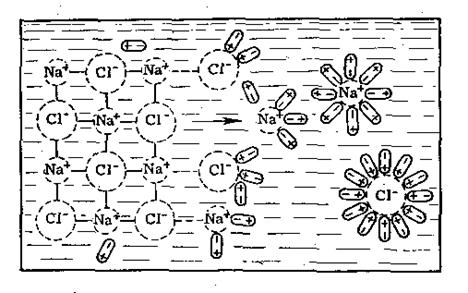
Рис.5. Схема розчинення кристалів солі NaCl у воді
Сольватацію можна розглядати на прикладі розчинення кристалів солі NaCl у воді (рис.5). Диполі води орієнтуються навкруги від’ємних іонів хлору своїм позитивним полюсом, а навкруги позитивних іонів натрію – від’ємним, тобто відбувається гідратація іонів. В результаті цього процесу зв’язок між поверхнево розташованими іонами в кристалі хлористого натрію послаблюється. Іони натрію і хлору відриваються від кристалу, а молекули води утворюють навкруги них так звану гідратну оболонку.
Процес розчинення у воді NaCl практично не має теплового ефекту, бо енергія гідратації майже дорівнює енергії руйнування кристалу.
При розчиненні у воді КСl з досить стійкою кристалічною граткою, іони К+ і Сl- гідратуються і енергія ΔН1, що виділяється при цьому, компенсує більшу частину енергії ΔН2, необхідної для руйнування кристалічної гратки. Отже, за абсолютним значенням ΔН2 >ΔН1 і при розчиненні КСl у воді теплота буде поглинатися з оточуючого середовища, тобто цей процес ендотермічний.
Розчинність кристалогідрату CuCl2∙2H2O супроводжується виділенням теплоти, тобто процес екзотермічний, бо енергія гідратації значно перевищує енергію руйнування твердого тіла.
Знак теплового ефекту визначає і вплив температури на розчинність. Процес розчинення більшості твердих речовин ендотермічний і з підвищенням температури розчинність збільшується.
Для деяких речовин з підвищенням температури розчинність зменшується, оскільки процес їх розчинення екзотермічний.
Розчинність твердих речовин завжди обмежена. Але абсолютно нерозчинних речовин в природі не існує, хоча і є речовини, практично не розчинні у воді. До них можна віднести BaSO4, CaCO3, CuS, AgCl та інші.
Як і будь-який фізико-хімічний процес, процес розчинення підкоряється певним закономірностям. Відомо, що швидкість хімічних процесів залежить від температури. Аналогічно, швидкість розчинення речовин при підвищенні температури збільшується, отже, збільшується і розчинність.
На швидкість розчинення впливають дифузія та ступінь подрібнення речовини. Швидкість переходу речовини з кристала в розчин, тобто швидкість гідратації, на два порядки більша, ніж швидкість дифузії гідратованої молекули (чи іона) у глибину розчину. Тому для того, щоб збільшити швидкість розчинення, розчин необхідно перемішувати. При цьому збільшується швидкість дифузії гідратованих частинок у розчин. Оскільки процес розчинення відбувається лише на поверхні розподілу фаз, то чим більшою є ступінь подрібнення речовин, тим більшою є його питома поверхня і, отже, вищою є швидкість розчинення.
4. ДИФУЗІЯ І ОСМОС В РОЗЧИНАХ. ЗАКОН ВАНТ-ГОФФА
Якщо в стакан із зафарбованим розчином якої-небудь речовини обережно влити розчинник, то на початку між шарами розчину і розчинника буде спостерігатися чітка межа розподілу.
Поступово межа розділу розмивається і через деякий час весь об'єм рідини набуває рівномірного зафарбування. Це відбувається в наслідок дифузії.
Дифузія - самовільний переніс рідини з області з більшою концентрацією в область з меншою концентрацією, або іншими словами це самовільний процес вирівнювання концентрацій.
В наведеному прикладі розчинена речовина з нижнього шару дифундує в шар чистого розчинника, а молекули розчинника переходять в шар розчину, де концентрація їх менше. Цей процес двосторонньої дифузії закінчиться вирівнюванням концентрації в усьому об'ємі.
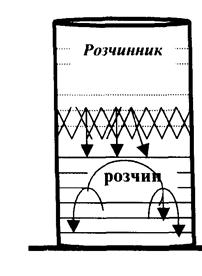 Швидкість дифузії вимірюється кількістю речовини, що переноситься за одиницю часу через одиницю площі.
Швидкість дифузії вимірюється кількістю речовини, що переноситься за одиницю часу через одиницю площі.
Рис. 6. Процес дифузії через мембрану
Вона пропорційна різниці концентрації в двох шарах рідини і температурі. Чим більша різниця концентрації і чим вища температура, тим швидкість дифузії більша. По мірі вирівнювання концентрації швидкість дифузії зменшується.
Дифузія може йти в тому випадку, якщо між шаром розчину і шаром розчинника помістити напівпроникну перегородку - мембрану. Напівпроникними перегородками для водних розчинів можуть бути природні плівки, стінки клітин, а також плівки, одержані штучним шляхом (целофан, пергамент). Через ці плівки можуть проходити молекули розчинника і не проходять молекули розчиненої речовини. Такі плівки називаються напівпроникними мембранами.
Дифузія відіграє значну роль в життєдіяльності організмів і технологічних процесах. Так, процес переміщення різних поживних речовин і продуктів обміну в живих організмах пов’язаний з дифузією. В технології харчування з дифузією мають справу при вимочуванні риби, заварюванні чаю, кави. Такі процеси як варка, пасерування, припускання також є практичним застосуванням дифузії.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 824; Нарушение авторских прав?; Мы поможем в написании вашей работы!