
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Явище осмосу. Закон Вант - Гоффа
|
|
|
|
Одностороння дифузія розчинника через напівпроникну мембрану в зону з більшою концентрацією називається осмосом.
Об'єм розчину в результаті осмосу збільшується, при цьому виникає тиск на стінки посудини, в якому знаходиться розчин. Цей тиск називається осмотичним. Осмотичний тиск можна виміряти за допомогою приладу - осмометра. Основною частиною осмометра єпосудина 1 з напівпроникного матеріалу 3, який заповнюється розчином 2 і розташовується в ємкості 4 з розчинником. В результаті осмосу об'єм 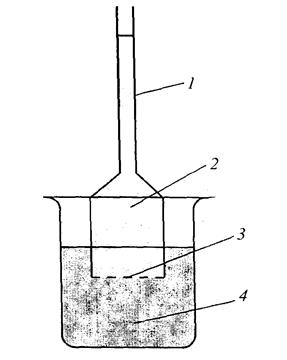 розчину в посудині 1 буде збільшуватися і він почне підніматися повертикальній трубці. Тиск стовпа рідини (гідростатичний тиск) що визначається висотою h, перешкоджає осмосу.
розчину в посудині 1 буде збільшуватися і він почне підніматися повертикальній трубці. Тиск стовпа рідини (гідростатичний тиск) що визначається висотою h, перешкоджає осмосу.
Коли гідростатичний тиск вирівнюється з осмотичним тиском настає рівновага. По висоті підйому рідини в трубці можна розрахувати гідростатичний тиск, що дорівнює в даному випадку осмотичному тиску.
Осмотичний тиск залежить від концентрації розчину і температури.
Рис.7. Схема осмометра:
1 – манометр; 2 – розчин; 3 – напівпроникна перегородка; 4 – розчинник.
Для розбавлених розчинів неелектролітів ця залежність виражається рівнянням Вант-Гоффа.
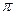 =
= 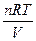 = CRT, бо С = n/v
= CRT, бо С = n/v
де: 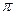 - осмотичний тиск, Па;
- осмотичний тиск, Па;
n - кількість розчиненої речовини (моль);
Т- абсолютна температура;
V - об'єм розчину;
R - постійна, прийнята рівною універсальній газовій сталій;
R = 8,314 • 103 Дж/(моль∙К).
Відповідність рівняння Вант—Гоффа по формі з рівнянням стану ідеального газу Клапейрона - Менделєєва дозволило зробити висновок, що осмотичний тиск розбавленого розчину дорівнює тому тиску, який необхідно прикласти до розчину, щоб привести його в рівновагу з чистим розчинником, що відокремлений від нього напівпроникною перегородкою. Цей висновок і є законом Вант-Гоффа. Закон Вант-Гоффа справедливий не для всіх розчинів. Розчини електролітів (солей, кислот, основ) мають більш високий осмотичний тиск, ніж розрахований за рівнянням Вант-Гоффа.
Розчини, що мають однаковий осмотичний тиск, називають ізотонічними.
Для таких розчинів Вант-Гофф ввів в це рівняння коефіцієнт і, що називається ізотонічним коефіцієнтом: П експ = і СRТ
Звідки і = 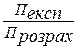
Ізотонічний коефіцієнт показує в скільки разів експериментально розрахований осмотичний тиск П експ. більший розрахованого П розрах.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1000; Нарушение авторских прав?; Мы поможем в написании вашей работы!