
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методом електронного балансу
|
|
|
|
ОСНОВИ
| Склад | Назва | ||
| Метал | Гідроксильна група ОН (одновалентна) | На першому місці – назва металу | На другому місці – слово гідроксид |
| Приклади: NaOH, Ca(OH)2 | NaOH – натрій гідроксид | ||
КЛАСИФІКАЦІЯ ОСНОВ
| Розчинні, або луги | Нерозчинні |
| Натрій гідроксид – NaOH | Ферум (ІІІ) гідроксид – Fe(OH)3 |
| Калій гідроксид – КОН | Магній гідроксид – Mg(OH)2 |
| Літій гідроксид – Li OH | Купрум (ІІ) гідроксид – Cu(OH)2 |
| Барій гідроксид – Ba(OH)2 | Алюміній гідроксид – Al(OH)3 |
ЩО ПОКАЗУЄ ХІМІЧНА ФОРМУЛА?
| Хімічна формула | Н2О | Н2SO4 |
| Назва речовини | вода | сульфатна кислота |
| Якісний склад | до складу води входять два елементи: Гідроген та Оксиген | до складу сульфатної кислоти входять три елементи: Гідроген, Сульфур, Оксиген |
| Кількісний склад | молекула води утворена двома атомами Гідрогену та одним атомом Оксигену | молекула сульфатної кислоти утворена двома атомами Гідрогену, одним атомом Сульфуру та чотирма атомами Оксигену |
| Відносна молекулярна маса | Мr(Н2О) = 1∙ 2 + 16 = 18 | Мr(Н2SО4) = = 1∙ 2+ 32 + 16 ∙ 4 = 98 |
| Масові співвідношення елементів | 2m(H): m(O) = = 2: 16 = 1: 8 | 2m(H): m(S): 2m(O) = = 2: 32: 64 = 1: 16: 32 |
| Масові частки елементів у речовині | w(H)=2 ∙1/18 ∙100% = 11% w(O)=16/18 ∙ 100% = 89% | w(H)=2 ∙ 1/98 ∙ 100% = 2% w(S)=32/98 ∙ 100% = 33% w(O)= 16 ∙ 4/ 98 ∙ 100% = =65% |
ХІМІЧНІ РЕАКЦІЇ
Хімічні рівняння – це умовні зображення реакцій за допомогою формул та, за необхідності, коефіцієнтів.
Реагенти → продукти реакції.
Щоб розставити коефіцієнти в хімічному рівнянні, слід пам’ятати, що сума атомів кожного елемента до реакції має дорівнювати сумі атомів кожного елемента після реакції.
Алгоритм складання рівняння реакцій за схемою.
Приклад: Мg + O2 →
1. Запишіть продукти реакції, склавши формули за валентностями:
ІІ ІІ
Мg + O2 → МgO
2. Обчисліть кількість атомів Оксигену до і після реакції (у простих реакціях коефіцієнти підбирають, починаючи з Оксигену):
②
Мg + O2 → МgO
2 1
3. Знайдіть найменше спільне кратне – 2 (записано в кружечку над стрілкою).
4. Поділіть найменше спільне кратне на кількість атомів Оксигену до реакції (2/2=1) та після реакції (2/1=2). Одержані коефіцієнти запишіть перед відповідними формулами (одиниця не записується):
Мg + O2 → 2МgO
5. Обчисліть кількість атомів Магнію до й після реакції (зверніть увагу на те, що коефіцієнт 2 перед МgO стосується формули речовини загалом):
②
Мg + O2 → 2МgO
1 2
6. Знайдіть найменше спільне кратне – 2 (записане над стрілкою).
7. Поділіть найменше спільне кратне на кількість атомів Магнію до реакції (2/1=2) та після реакції (2/2=1). Отримані коефіцієнти запишіть перед відповідними формулами (одиниця не записується):
2Мg + O2 → 2МgO
8. Після того як коефіцієнти розставлено, схема реакції стає рівнянням.
Приклад: К + О2 →
1. Запишіть схему реакції, складіть формулу продукту реакції за валентностями: І ІІ
К + О2 → К2О
2. Атомів Оксигену до реакції є два, після реакції – один атом:
②
К + О2 → К2О
2 1
3. Найменше спільне кратне – 2. Отримуємо коефіцієнт для Оксигену: 2/2=1; 2/1=2.
К + О2 →2К2О
Підбираємо коефіцієнти для Калію (до реакції – 4/1=4; після реакції – 4/4=1): ②
4К + О2 →2К2О
СКЛАДАННЯ РІВНЯНЬ МОЖЛИВИХ РЕАКЦІЙ
1. Взаємодія металів з водою.
За нормальних умов вода реагує з активними металами, утворюючи гідроксиди металів (луги) та водень:
2Na + 2H2O → 2NaOH + H2
2. Взаємодія оксидів металів із водою.
За нормальних умов вода реагує з оксидами активних металів, утворюючи розчинні гідроксиди металів (луги):
Na2O + H2O → 2NaOH
3. Взаємодія оксидів неметалів з водою.
За нормальних умов вода реагує з оксидами неметалів, утворюючи кислоти:
CO2 +2H2O → H2CO3
4. Взаємодія оксидів неметалів з гідроксидами.
Оксиди неметалів реагують з лугами, утворюючи сіль та воду:
2KOH + CO2 → K2CO3 + H2O
5. Взаємодія металів з кислотами.
Дослідження показують, що всі метали за активністю витіснення Гідрогену можна розмістити в ряд (так званий витиску вальний ряд):
Li, K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2 Cu, Hg, Ag, Pt, Au
Метали, що стоять ліворуч від Гідрогену, здатні витісняти його з кислот (крім нітратної кислоти), а ті, що розташовані праворуч від Гідрогену, - ні:
FeO + 2HCl → FeCl2 +H2
Cu + HCl ǂ
6. Взаємодія кислот з оксидами.
Кислоти реагують з оксидами металів (основними оксидами), утворюючи сіль та воду:
FeO + 2HCl → FeCl2 + H2O
7. Взаємодія кислот з основами.
Реакції між основами й кислотами, в процесі яких утворюються сіль та вода, називаються реакціями нейтралізації:
3KOH + H3PO4 → K3PO4 + 3H2O
8. Взаємодія кислот із солями.
Реакції між кислотами й солями можливі, якщо вільна кислота сильніша за кислоту, що міститься в солі (відповідно до ряду кислот):
 сила кислот зменшується
сила кислот зменшується
HNO3
H2SO4, HCl, H2SO3, H2CO3, H2S, H2SiO3
H3PO4
H2SO4 + K2CO3 → K2SO4 + H2CO3
9. Взаємодія основ із солями.
Реакції між основами й солями можливі, якщо основа – луг, сіль – розчинна та утворена не лужним металом:
2KOH + CuCl2 → Cu(OH)2 + 2KCl
10. Взаємодія солей із солями.
Реакції між солями можливі, якщо обидві солі розчинні, а в результаті реакції утворюється нерозчинна сіль:
CaCl2 + K2CO3 → CaCO3↓ + 2KCl
11. Взаємодія солей з металами.
Під час написання цих реакцій слід керуватися витискувальним рядом
металів (див. п.5):
CuSO4 + Fe → FeSO4 +Cu
ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ
Хімічні реакції відбуваються з різною швидкістю. Одні реакції здійснюються за частки секунд; інші – протягом тисячоліть. Миттєво відбувається реакція нейтралізації кислоти лугом, а перетворення граніту на глину, вивітрювання гірських порід – це хімічні реакції, які тривають віками.
Чинники, які впливають на швидкість хімічних реакцій:
 природа речовин (міцність хімічних зв’язків впливає на швидкість реакції);
природа речовин (міцність хімічних зв’язків впливає на швидкість реакції);
 агрегатний стан речовини (найбільшу швидкість мають молекули газів, найменшу – частинки твердої речовини);
агрегатний стан речовини (найбільшу швидкість мають молекули газів, найменшу – частинки твердої речовини);
 ступінь подрібнення (якщо речовину подрібнити, то збільшується поверхня стикання речовин і швидкість реакцій між ними);
ступінь подрібнення (якщо речовину подрібнити, то збільшується поверхня стикання речовин і швидкість реакцій між ними);
 концентрація реагуючих речовин (у чистій речовині число зіткнень молекул буде більшим і швидкість вищою);
концентрація реагуючих речовин (у чистій речовині число зіткнень молекул буде більшим і швидкість вищою);
 тиск (для газів): швидкість реакцій між газами можна збільшити за допомогою тиску;
тиск (для газів): швидкість реакцій між газами можна збільшити за допомогою тиску;
 температура (нагрівання речовин сприяє збільшенню активних молекул, тому й швидкість реакцій у разі нагрівання зростає в 2-4 рази на кожні 10°С);
температура (нагрівання речовин сприяє збільшенню активних молекул, тому й швидкість реакцій у разі нагрівання зростає в 2-4 рази на кожні 10°С);
 наявність каталізатора (речовина, яка змінює швидкість або напрямок реакції, а сама при цьому не змінюється).
наявність каталізатора (речовина, яка змінює швидкість або напрямок реакції, а сама при цьому не змінюється).
КАТАЛІЗ
Каталіз – це явище зміни швидкості реакції за наявністю каталізатора.
Позитивний каталіз: каталізатор прискорює швидкість реакції.
MnO2 (каталізатор)
 2KClO3 2KCl + 3O2
2KClO3 2KCl + 3O2
V2O3 (каталізатор)
 2SO2 + O2 2SO3
2SO2 + O2 2SO3
MnO2 (каталізатор)
 2H2O2 2H2O + O2↑
2H2O2 2H2O + O2↑
Негативний каталіз: каталізатор сповільнює швидкість реакції. Наприклад, якщо необхідно зменшити корозію металів.
Каталізатор – це речовина, яка змінює швидкість або напрямок реакції, а сама при цьому не змінюється.
Інгібітори – це каталізатори, які сповільнюють реакцію.
Реакції, що відбуваються за наявністю каталізаторів, називаються каталітичними. Реакції, що відбуваються без каталізаторів, називаються некаталітичними.
КЛАСИФІКАЦІЯ ХІМІЧНИХ РЕАКЦІЙ
1.Реакції сполучення:
А + В + С → D
декілька речовин продукт -
простішого складу складніша речовина
Реакції сполучення – це такі реакції, в результаті яких з декількох вихідних речовин (простих чи складних) утворюється одна складна речовина.
S + O2 → SO2
CO2 + H2O → H2CO3
SO2 + CaO → CaSO3
CaCO3 + H2O + CO2 → Ca(HCO3)2
2. Реакція розкладу:
А → В + С + D
складніша декілька речовин
речовина простішого складу
Реакції розкладу – хімічні реакції, в результаті яких з однієї складної речовини утворюються дві або більше нових речовин.
Cu(OH)2 → CuO + H2O
BaSO3 → BaO + SO2
t
4HNO3 → 2H2O + 4NO2 + O2
2KClO3 → 2KCl + 3O2
3.Реакції заміщення:
А + ВС → АВ + С
проста складна складна проста
речовина речовина речовина речовина
Реакції заміщення – це хімічні реакції, що відбуваються між простою та складною речовинами та в результаті яких атоми простої речовини заміщують атоми одного з елементів у складній речовині.
CuSO4 + Fe → FeSO4 + Cu
2KBr + Cl2 → 2KCl + Br2
2Na + 2H2O → 2NaOH + H2↑
Zn + 2HCl → ZnCl2 + H2↑
4.Реакції обміну:
АВ + СD ↔ АС + ВD
обмін складовими частинами
Реакції обміну – це реакції між двома складними речовинами, в результаті яких вони обмінюються своїми складовими частинами.
KOH + HCl → KCl + H2O
AgNO3 + KBr → AgBr↓ +KNO3
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
2NaCl + H2SO4 → Na2SO4 + 2HCl↑
ПРИНЦИП ЛЕ ШАТЕЛЬЄ
Якщо змінити одну з умов, за яких система перебуває у стані рівноваги, − температуру, тиск або концентрацію, − то рівновага зміщується в напрямку тієї реакції, яка протидіє цій зміні.
В необоротних реакціях зворотний процес виражений слабо. До них відносяться реакції, під час перебігу яких:
Ø один із продуктів, що утворюється, виходить зі сфери реакції:
a) випадає в осад: BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
б) виділяється у вигляді газу:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Ø утворюється малодисоційована сполука, наприклад, вода:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Ø реаккія супроводжується виділенням великої кількості енергії:
2Mg + O2 → 2MgO
ЕНЕРГЕТИЧНИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ
Під час хімічної реакції відбувається розрив одних зв’язків та утворення інших. Якщо сума енергій зруйнованих зв’язків більше суми енергій новоутворених, то надлишок енергії виділяється у вигляді теплоти, світла, роботи газів, які розширюються.
 Теплота виділяється – реакція екзотермічна.
Теплота виділяється – реакція екзотермічна.
 Теплота поглинається – реакція ендотермічна.
Теплота поглинається – реакція ендотермічна.
Тепловий ефект реакції – це теплота, що виділяється або поглинається під час хімічної реакції.
Позначається тепловий ефект реакції ∆Н (дельта-аш). Виражається у джоулях (Дж) або кілоджоулях (кДж).
Тепловий ефект реакції ∆Н – це різниця між вмістом енергії у вихідних речовинах і кінцевих продуктах реакції.
 Тепловий ефект хімічної реакції залежить від стану вихідних речовин і
Тепловий ефект хімічної реакції залежить від стану вихідних речовин і
продуктів реакції.
 Тепловий ефект для екзотермічних реакцій, коли теплота виділяється, а
Тепловий ефект для екзотермічних реакцій, коли теплота виділяється, а
енергія реакційної системи зменшується, буде негативним.
 Для ендотермічних реакцій – навпаки, тепловий ефект буде позитивним.
Для ендотермічних реакцій – навпаки, тепловий ефект буде позитивним.
ОКИСЛЮВАЛЬНО – ВІДНОВНІ РЕАКЦІЇ
 Відновлення (процес приєднання ē)
Відновлення (процес приєднання ē)
 Ступені окиснення −4 −3 −2 −1 0 +1 +2 +3 +4 +5 +6 +7
Ступені окиснення −4 −3 −2 −1 0 +1 +2 +3 +4 +5 +6 +7
Окиснення (процес втрати ē)
Окисник – речовина, що містить елемент, ступінь окиснення якого в ході реакції знижується: Е0 + nē → Е−n .
Відновник – речовина, що містить елемент, ступінь окиснення якого в ході реакції підвищується: Е0 – nē → Е+n .
ВИЗНАЧЕННЯ СТУПЕНІВ ОКИСНЕННЯ
Ступінь окиснення – це умовний заряд атома за умови, що всі зв’язки – йонні.
Валентність визначається як число хімічних зв’язків, якими певний атом пов’язаний з іншими. Валентність не має знаку й не може бути нульовою. Валентність не завжди дорівнює ступеню окиснення.
· Алгебраїчна сума ступенів окиснення всіх атомів у речовині дорівнює нулю.
· Ступінь окиснення атома елемента у вільному стані дорівнює нулю.
· Ступінь окиснення металів завжди додатний.
· Ступінь окиснення Гідрогену в сполуках, зазвичай, дорівнює +1.
· Ступінь окиснення Оксигену в сполуках, зазвичай, дорівнює –2.
· Вищий ступінь окиснення атомів хімічного елемента додатний, його значення визначається номером групи, в якій знаходиться елемент у періодичній системі.
· Нижчий ступінь окиснення (лише для неметалів) визначається за формулою: 8 − № групи. У бінарних сполуках більш електронегативний елемент проявляє нижчий ступінь окиснення (записується праворуч).
Якщо ступінь окиснення має позитивний заряд – атом віддав електрони; якщо знак від’ємний – атом приєднав електрони.
H+Cl−, Ca+2O−2 , C−4H4+1, H2+1S+6O4−2, Na2+1C+4O3−2, H2+1S−2
АЛГОРИТМ СКЛАДАННЯ РІВНЯННЯ
ОКИСЛЮВАЛЬНО – ВІДНОВНИХ РЕАКЦІЙ
1. Запишіть схему реакції.
2. Визначте ступені окиснення атомів елементів до й після реакції.
3. Підкресліть знаки хімічних елементів, які змінюють ступені окиснення.
4. Складіть електронні рівняння, що показують процеси віддавання та приєднання електронів, зрівняйте заряди.
5. Зрівняйте кількість відданих та приєднаних електронів, визначаючи коефіцієнти при окиснику та відновнику.
6. Підпишіть процеси окиснення та відновлення, вкажіть окисник та відновник.
7. Складіть рівняння реакцій та розставте коефіцієнти.
Приклад: Al0 + O20 → Al2+3O3−2 (виконано пункти 1 – 3).
Складаємо електронні рівняння, що показують процеси віддавання та приєднання електронів, зрівнюючи заряди:
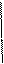
 Al0 − 3ē → Al+3 4 окиснення, відновник
Al0 − 3ē → Al+3 4 окиснення, відновник
O20 + 4ē → 2O−2 3 відновлення, окисник
Виставляємо одержані коефіцієнти в рівняння:
4 Al + 3 O2 → 2 Al2O3
ХІМІЧНА РІВНОВАГА
Хімічні реакції часто відбуваються в прямому і зворотному напрямках.

 Реагенти продукти реакції.
Реагенти продукти реакції.
2SO2 +O2 → 2SO3 (пряма реакція)
2SO3 → 2SO2 +O2 (зворотна реакція)
Це означає, що в цій системі одночасно здійснюються два протилежні процеси. Сумарне рівняння записується так:
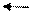
 2SO2 +O2 2SO3
2SO2 +O2 2SO3
Хімічні реакції, що за одних і тих самих умов відбуваються в протилежних напрямках, називаються оборотними.
Хімічні реакції, що за певних умов відбуваються тільки в прямому напрямку, називаються необоротними. Реагенти → продукти реакції.
HCl +AgNO3 → AgCl↓ +HNO3
Хімічна рівновага – це такий стан системи, коли швидкість прямої реакції дорівнює швидкості оборотної реакції: Vпр. = Vоб.
Скільки молекул вихідних речовин вступає в пряму реакцію, стільки саме їх утвориться в результаті зворотної реакції.
ЧИННИКИ, ЯКІ ВПЛИВАЮТЬ НА СТАН ХІМІЧНОЇ РІВНОВАГИ.
Концентрація. Якщо збільшити концентрацію реагентів, то рівновага зміститься в бік утворення продуктів. Якщо весь час видаляти продукти реакції, то рівновага зміщується вправо.
Температура. Якщо оборотна реакція екзотермічна, то в разі підвищення температури хімічна рівновага зміщується в бік утворення вихідних речовин, а в разі зниження температури – в бік утворення продуктів реакції. Якщо оборотна реакція ендотермічна, - то навпаки.
Наприклад: у реакції синтезу амоніаку (реакція екзотермічна) в разі підвищення температури хімічна рівновага зміщується в бік утворення вихідних речовин – азоту N2 і водню Н2, а вразі зниження температури – в бік утворення продукту реакції амоніаку NН3.

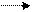 N2 + 3H2 2NH3
N2 + 3H2 2NH3



 Вплив тиску. В разі підвищення тиску хімічна рівновага зміщується в бік зменшення об’ємів (N2 + 3H2 2NH3 ), а в разі зменшення тиску – в бік зростання об’ємів (2NH3 N2 + 3H2 ).
Вплив тиску. В разі підвищення тиску хімічна рівновага зміщується в бік зменшення об’ємів (N2 + 3H2 2NH3 ), а в разі зменшення тиску – в бік зростання об’ємів (2NH3 N2 + 3H2 ).
Якщо реакція відбувається без зміни об’ємів реагуючих газів, наприклад,
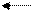
 N2 + О2 2NО, то тиск не впливає на стан рівноваги.
N2 + О2 2NО, то тиск не впливає на стан рівноваги.
ПЕРІОДИЧНИЙ ЗАКОН ТА ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 671; Нарушение авторских прав?; Мы поможем в написании вашей работы!