
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спирт етиловий (Spirtus aethylicus)
|
|
|
|
Спирти
Спиртами називають органічні речовини, в молекулах яких групи OH зв’язані з аліфатичним ланцюгом або з насиченим кільцем. Низькомолекулярні спирти розчиняються у воді та мають наркотичні властивості. Метанол (CH3OH) є досить сильною отрутою. Етанол значно менш токсичний від метанолу. З зростанням молекулярної ваги ростуть токсичні та наркотичні властивості спиртів, причому наявність розгалуження вуглеводневого ланцюга та ненасичених зв’язків посилює їх фізіологічну дію. Почавши від октанолів, фізіологічна властивість починає зменшуватися, так що спирти, які містять 16 і більше атомів вуглецю, практично інертними речовинами.

Спирти - речовини нейтрального характеру, однак вони утворюють при дії деяких металів (металічний натрій) нетривкі алкоголяти. Спирти ароматичного та терпенового рядів мають слабкі антисептичні властивості, деякі з них проявляють відхаркувальну та заспокійливу дію.
В залежності від кількості OH-груп двохатомні спирти називають гліколями, а триатомні – гліцеринами. Введення декількох груп OH в молекулу речовин веде до значного пониження їх фізіологічної активності. Так, глікол, гліцерин чи мані практично не проявляють наркотичних властивостей.
Розглянемо окремі представники спиртів, які вживаються як лікарські засоби.
C2H5OH M = 46,07
Етиловий спирт добувають на спиртозаводах з рослинної сировини, що містить крохмаль, наприклад, з картоплі, жита, рижу тощо. Рослинний матеріал розмелюють та заварюють перегрітою водяною парою при температурі 140 – 150º, причому утворюється густа маса, що містить крохмаль у вигляді „клейстеру”. Після охолодження маси додають до неї „солод”, що являє собою здрібнені пророслі зерна ячменю. В „солоді” знаходиться ензим „діастаза”, який здатний перетворювати крохмаль в мальтозу.
Приєднання води до крохмалю проходить найлегше при температурі 62º. До продукту реакції додають дріжджі та проводять бродіння при температурі 33º. Завдяки наявності в дріжджах ензиму „мальтаз” мальтоза перетворюється в глюкозу:
C12H22O11 + H2O = 2C6H12O6
При подальшому бродінні глюкози утворюється винний спирт та CO2:
C6H12O6 = 2CO2 + 2C2H5OH
Проміжними продуктами при перетворенні глюкози в винний спирт є метилгліоксаль (CH3COCHO), піровиноградна кислота (CH3COCOOH),ацетальдегід (CH3CHO).При бродінні утворюється (з білкових речовин тощо) сивушні масла, в склад яких входять вищі гомологи етанолу.
Після закінчення бродіння одержаний спирт переганяють в спеціальних ректифікаційних апаратах.
В останній час розроблено промисловий метод добування спирту методом бродіння продукту гідролізу целюлози, а також з етилену і ацетилену. Гідратація етилену може бути проведена безпосередньо водою при високому тиску:
CH2=CH2 + H2O = CH3CH2OH
Можна так адсорбувати етилен в концентрованій сульфатній кислоті та провести гідроліз утвореної етилсульфатної кислоти (CH3CH2 – OSO3H). Добування спирту з ацетилену полягає, найчастіше, в гідратації ацетилену до ацетальдегіду CH3CHO і гідруванні останнього до етанолу.
Розрізняють:
1)Спирт 93 - 95%
2)95 – 96%
3)абсолютний спирт – 100% -ва речовина
Етиловий спирт – безбарвна рідина з характерним запахом та пекучим смаком. Містить приблизно 96,4% C2H5OH. Горить синюватим полум’ям.
Змішується в кожному співвідношенні з водою, ефіром і хлороформом. Питома вага 0,812 – 0,816. Температура кипіння 77 – 78,5º (чистий азеотроп кипить при температурі 78,15º). Абсолютний спирт не можна одержати шляхом фракційної дистиляції, а тільки хімічним шляхом, наприклад зневодненням за допомогою CaO, безводним мідь-сульфатом, металічним кальцієм тощо. Зневоднення спирту проводять також бензолом. При перегонці етилового спирту з бензолом при температурі 64,85º кипить „потрійний азеотроп”, який складається з бензолу, води і спирту, потім при 68,25º - звичайний азеотроп спирту і бензолу та, наприкінці перегонки, при температурі 78,3º - абсолютний алкоголь.
З метою ідентифікації нагрівають суміш препарату з ацетатною кислотою та концентрованою сульфатною кислотою. При цьому утворюється етилацетат з характерним фруктовим запахом:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Аналогічну реакцію дає також метанол (утворення СН3СООСН3). При нагріванні етилового спирту з розчином калій-гідроксиду та декількома краплями 0,1 н. розчину йоду випадає жовтий осад йодоформу (з характерним неприємним запахом):
C2H5OH + 4J2 + 4KOH = CHJ3 + 5KJ + HCOOK + 5H2O
Аналогічну реакцію дає ацетон, лактатна кислота і ацетальдегід, не дає її метанол.
Для виявлення метанолу, як недозволеної домішки, змішують препарат з розчином калій-перманганату та сульфатною кислотою, причому вже на холоді метанол оксидується до формальдегіду:
5CH3OH + 2KMnO4 + 4H2SO4 = 5CH2O + 2MnSO4 + 2KHSO4 + 8H2O
Надвишок калій-перманганату через 2 – 3 хв. розкладають оксалатною кислотою та до продукту реакції додають реактив Шиффа (розчин фуксину, знебарвлений сульфітною кислотою).Виникає рожеве або червоне забарвлення.


Гексаметилентетрамін Hexamethylentetraminum



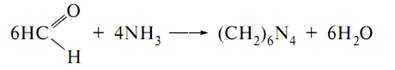

В зв’язку з тим, що уротропін розкладається при допомозі сульфатної кислоти, він дає кольорові реакції з морфіном та саліцилатною кислотою, аналогічно як формалін.

Кількісне визначення:
1. кислотно-основне зворотне титрування, препарат кип’ятять з відомою кількістю 0,1 М розчину сульфатної кислоти до повного видалення формальдегіду, а потім відтитровують надвишок сульфатної кислоти 0,1 М розчином NaOH при наявності метилового червоного:


Препарат можна також визначити йодометрично (Ю. П. Китаєв) після осадження тетрайодиду відомою кількістю 0,1 н. йоду.
Уротропін застосовують як дезинфекційний засіб при циститах, пієлітах та інших захворюваннях сечових шляхів. Назва препарату походить від грецьких слів: oύpoν– сеча, τpεπεiv – змінювати.
Уротропін входить в склад таблеток „к а л ь ц е к с ”, які містять комплексну сіль уротропіну з кальцій-хлоридом та застосовуються при простудних захворюваннях. За кордоном вживають ряд різних солей уротропіну, наприклад, з саліцилатною кислотою (Solurine, Vesalvine S, Urazine), ангідрометиленцитратною кислотою (Formanol, Heimitoi) і т. д. Комплексна сполука уротропіну з натрій-ацетатом називається Cystopurin і Genatosan.
ЛЕКЦІЯ №9
Тема: Лікарські засоби – похідні карбонових кислот та амінокислот аліфатичного ряду.
ПЛАН:
· Загальна характеристика карбонових кислот аліфатичного ряду.
· Солі лимонної (цитринової) кислоти: натрію цитрат, натрію гідроцитрат.
· Загальна характеристика амінокислот аліфатичного ряду.
· Кислота глутамінова.
КАРБОНОВІ КИСЛОТИ ТА ЇХ СОЛІ
Карбоновими кислотами називаються органічні сполуки, в молекулах яких знаходиться карбоксильна група – СООН. Жирні карбонові кислоти малотоксичні, широко розповсюджені у природі.
Хімічні властивості препаратів визначаються властивостями карбоксильної групи.
Органічні карбонові кислоти з солями металів в нейтральному середовищі утворюють осади різного кольору.
Нижчемолекулярні представники ряду кислот розчиняються у воді та дисоціюють за такою схемою:
RСООН+Н2О↔RСОО¯+Н3О+
Карбонові кислоти утворюють солі не тільки при розчиненні у лугах але і в розчинах бікарбонатів (на відміну від фенолів):
RСООН+NаНСО3=RСООNа+Н2О+СО2
Найбільш характерною реакцією на карбонові кислоти є утворення складних ефірів RСООR. Аліфатичні оксикислоти дають з залізом ІІІ-хлоридом інтенсивне жовте забарвлення, а ароматичні оксикислоти – фіолетове або синє забарвлення.
Карбонові кислоти та їх солі мають дуже різноманітну фізіологічну дію, яка, головним чином, залежить від залишку, зв’язаного з карбоксильною групою. Серед карбонових кислот та їх солей знаходяться антисептичні засоби (бензоатна, саліцилова, трихлорацетатна, ундецилинатна кислоти), жовчогінні речовини (дегідрохлоратна кислота та дехолін), протиревматичні засоби (натрій –саліцилат) і т. д. Деякі кислоти застосовуються при виготовленні шипучих порошків (тартратна і цитратна кислоти).
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1228; Нарушение авторских прав?; Мы поможем в написании вашей работы!