
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Отримання
|
|
|
|
Парацетамол (Paracetamolum) (ДФУ)
4-
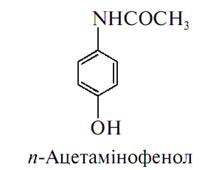
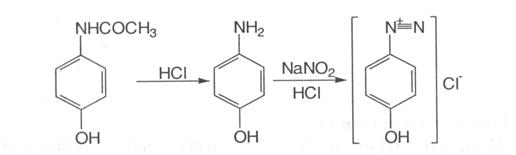
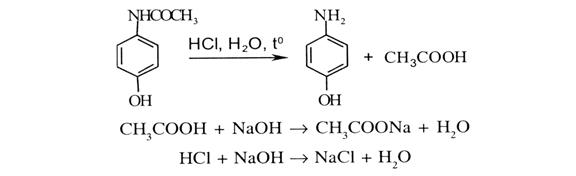
Отримується синтетичним шляхом. Фенол нітрозують натрію нітритом у кислому середовищі. Утворений п-нітрозофенол відновлюють сірководнем в аміачному середовищі до п-амінофенолу, який ацетилюють:
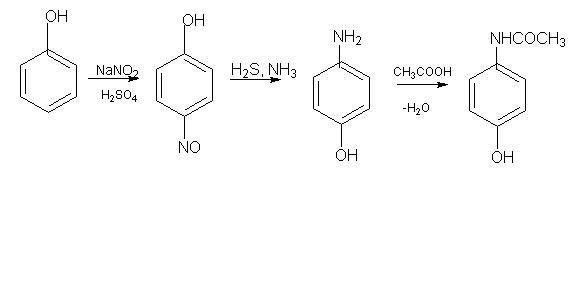
Властивості: кристалічний порошок білого кольору. Помірно розчинний у воді, легко розчинний у 96% спирті, дуже мало розчинний у метиленхлориді. Завдяки фенольному гідроксилу розчиняється у лугах.
Ідентифікація:
1. За фізико-хімічними константами: температурою топлення, УФ- та ІЧ-спектроскопія.
2. При нагріванні з калію дихроматом у присутності кислоти утворюється індофенол фіолетового кольору, який переходить у червоний: 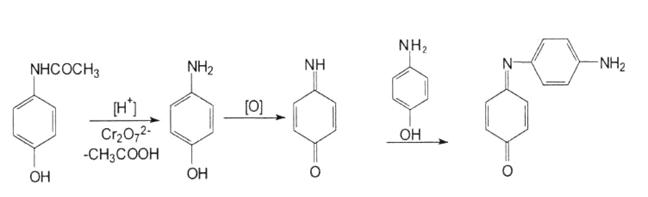
3. Субстанція дає реакцію на ацетил після нагрівання на відкритому полум’ї.
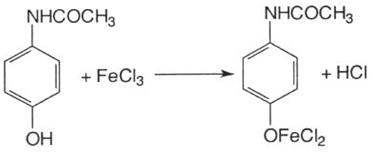
4. З розчином хлориду заліза ІІІ утворюється синьо-фіолетове забарвлення:
5.Наявність фенолоного гідроксилу зумовлює реакцію парацетамолу із солями діазонію – утворюється азобарвник червоного кольору:
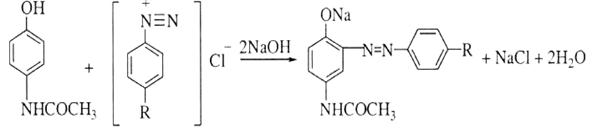
6.Після кислотного гідролізу, під час якого утворюється первинна ароматична аміногрупа, лікарська речовина дає реакцію діазотування з наступним азосполученням:
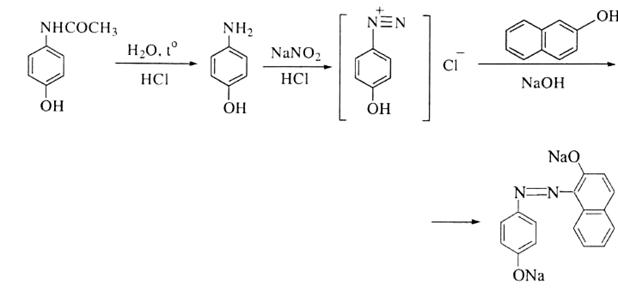
Кількісне визначення:
1. Цериметрія (ДФУ) після попереднього гідролізу субстанції кислотою сірчаною розведеною і подальшим титруванням розчином церію сульфату IV, індикатор фероїн. Паралельно проводять контрольний дослід, s = 1/2:
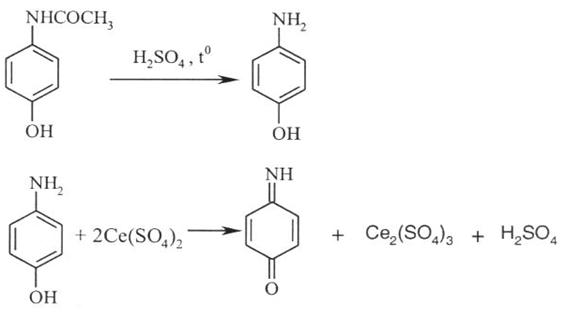
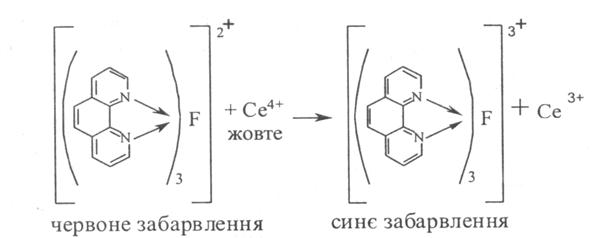
2. Нітритометрія після гідролізу лікарської речовини, пряме титрування, індикатор – йоддикрахмальний папір, s = 1:
Точку еквівалентності визначають за посинінням йодкрахмального паперу від надлишкової краплі титранту:
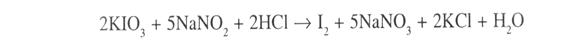
3. Алкаліметрія після кислотного гідролізу, пряме титрування, індикатор – фенолфталеїн, s =1. Паралельно проводять контрольний дослід:
Зберігання. У добре закупореній тарі, що вберігає від дії світла.
Застосування. Жарознижуючий та болезаспокійливий засіб.
Лікарські засоби – похідні амідів сульфанілової кислоти
Сульфанілова кислота є джерелом для отримання великої кількості лікарських засобів, об’єднаних за своєю хімічною будовою і за фармакологічною дією в одну групу сульфаніламідних лікарських засобів загальної формули:
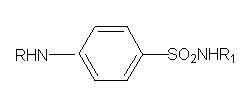
Сульфаніламідні препарати з’явились в 30-х роках ХХ сторіччя. Історія їх відкриття пов’язана з текстильною промисловістю. В пошуках кращих фарбників в 1908 році синтезовано п-амінобензолсульфамід, названий пізніше білим стрептоцидом. Отже, в основі хімічної структури сульфаніламідних препарвтів лежить білий стрептоцид, з якого шляхом заміщення атомів гідрогену в сульфамідній групі та ароматичній аміногрупі різноманітними радикалами можна отримати велику кількість різноманітних препаратів з характерною для кожного дією.
Отримання. Найбільш раціональним і економічним є синтез з карбометоксианіліну:
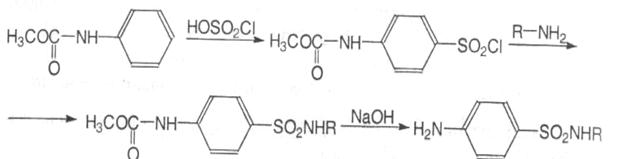
Хімічні властивості та ідентифікація.
1. Більшість сульфаніламідних речовин – амфотерні сполуки. Основні властивості обумовлені наявністю ароматичної аміногрупи. Як основи вони розчиняються в кислотах, утворюючи солі:
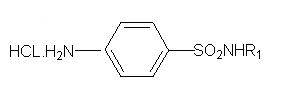
Однак солі у воді сильно гідролізовані і практично не існують.
Кислі властивості зумовлені наявністю водню в сульфамідній групі, який може заміщуватись на метали з утворенням солей. Лікарські засоби легко розчиняються в лугах і карбонатах лужних металів:
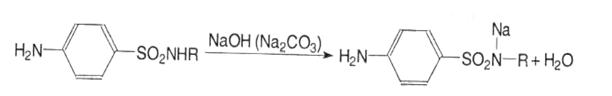 На здатність розчинятись в лугах впливає характер замісника в сульфамідній групі (R). Якщо радикал має сильно виражені основні властивості, такий лікарський засіб у лугах не розчиняється.
На здатність розчинятись в лугах впливає характер замісника в сульфамідній групі (R). Якщо радикал має сильно виражені основні властивості, такий лікарський засіб у лугах не розчиняється.
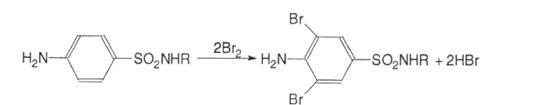
2. Усі сульфаніламіди можуть галоїдуватись, нітруватись, сульфуватись по ароматичному кільцю:
3. За рахунок наявності первинної ароматичної аміногрупи сульфаніламіди вступають у реакції діазотування з наступним азосполученням. У результаті реакції з’являється вишнево-червоне забарвлення або випадає осад оранжево-червоного кольору: 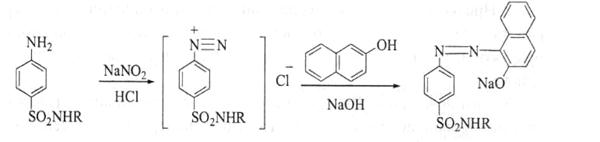
Виняток складають сульфаніламіди, які мають заміщену ароматичну аміногрупу (стрептоцид розчинний, фталазол та ін.). Цю реакцію вони дають після гідролізу.
4. Для виявлення атома сірки в сульфамідній групі лікарський засіб окиснюють кислотою нітратною концентрованою або сплавляють з 10- кратною кількістю калію нітрату. Отримані при цьому сульфати визначають за реакцією з розчином барію хлориду:
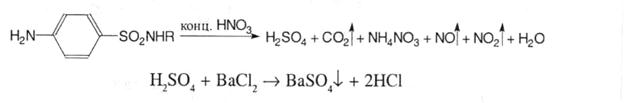
5. Кислі властивості сульфамідної групи зумовлюють можливість взаємодії з солями важких металів (міді сульфатом ІІ, кобальту хлоридом ІІІ, заліза хлоридом ІІІ). При цьому утворюються забарвлені в різний колір комплекси, розчинні або нерозчинні у воді. Лікарський засіб розчиняють у 0,1М розчині натрію гідроксиду, а потім додають розчини солей важких металів. Не повинно бути надлишку лугу, оскільки можуть випасти в осад гідроксиди важких металів. Реакція із солями важких металів дає можливість ідентифікувати лікарські засоби цієї групи: 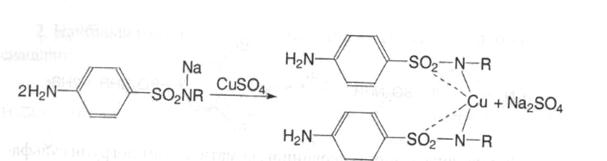
6. При додаванні до розчину сульфаніламіду 1% розчину натрію нітропрусиду в присутності натрію гідроксиду і подальшому підкисленні утворюються червоні або червоно-коричневі розчини чи осади.
7. При нагріванні лікарських речовин у сухій пробірці (піроліз) утворюються плави різного кольору і виділяються різноманітні газоподібні продукти. Ця реакція дозволяє відрізнити деякі сульфаніламіди один від одного.
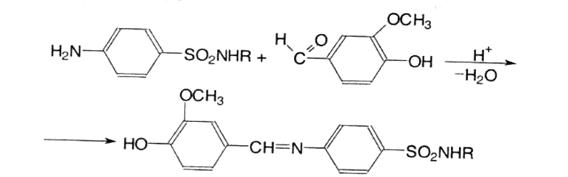
8. Лігнінова проба. Використовується для експрес-аналізу. Проводять на деревині або на невибіленому газетному папері, при нанесенні які сульфаніламіду або іншої речовини з первинною ароматичною аміногрупою ц краплі хлороводневої кислоти з’являється оранжево-червоне забарвлення. У результаті гідролізу лігніну утворюються ароматичні альдегіди, які реагують з первинною ароматичною аміногрупою з утворенням основ Шиффа:
9. Для ідентифікації сульфаніламідів використовують УФ- та ІЧ- спектроскопію.
Кількісне визначення.
1.Більшість лікарських засобів цієї групи визначають методом нітритометрії. Речовину титрують розчином натрію нітриту у кислому середовищі хлороводневої кислоти в присутності каталізатора калію броміду при температурі не вище 20ºС. Індикатори внутрішні тропеолін-00 або зовнішні; s= 1:
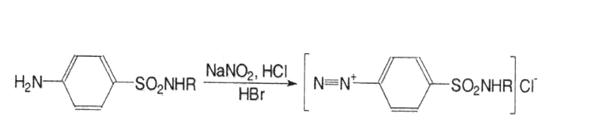
2. Алкаліметрія. Грунтується на кислих властивостях сульфамідної групи. Кислотні форми титрують розчином натрію гідроксиду в
присутності індикатора тимолфталеїну; s=1:
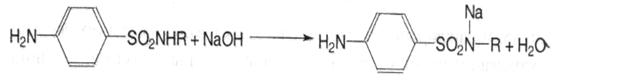
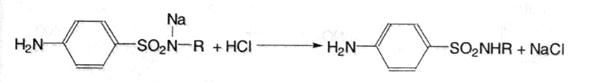
3. Ацидиметрія. Натрієві солі сульфаніламідів можна титрувати кислотою хлороводневою в спиртово-ацетоновому середовищі, індикатор метиловий оранжевий; s=1:
4. Броматометрія. Метод грунтується на реакції галогенування сульфаніламідних лікарських речовин. Титрованим розчином є калію бромат. Надлишок брому визначається йодометрично, індикатор – крохмаль; s=1,5:
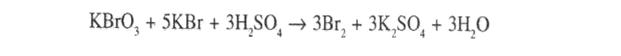
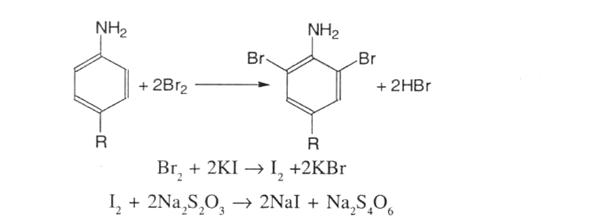
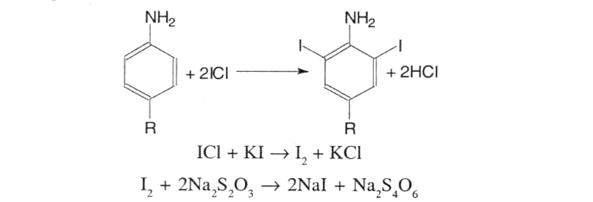
5. Йодхлорметрія. Полягає в галогенуванні лікарських речовин титрованим розчином йодмонохлориду, надлишок якого визначають йодометрично; s = ½:
6. Аргентометрія. Деякі сульфаніламіди можуть утворювати солі при взаємодії із срібла нітратом (норсульфазол):
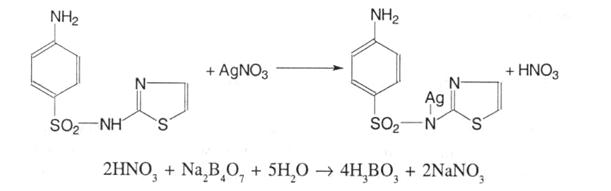
Для зниження концентрації іонів гідрогену, які роблять реакцію оборотною і розчиняють осад, титрування проводять у присутності натрію тетраборату, індикатор – калію хромат (метод Мора); s = 1.
7. Фотоколориметрія. Грунтується на здатності сульфаніламідних лікарських засобів утворювати азобарвники.
8. Спектрофотометричні методи кількісного визначення.
Застосування. Як хіміотерапевтичні лікарські засоби для лікування захворювань, викликаних стрептококками, гонококками, менінгококками, стафілококками, кишковою паличкою.
Фармакологічна активність сульфаніламідів пояснюється теорією конкурентного анатагонізму. Їх дія пов’язується з порушенням утворення мікроорганізмами необхідних для розвитку ростових факторів – фолієвої та дигідрофолієвої кислот та інших речовин, у молекулу яких входить п-амінобензойна кислота. Сульфаніламідні препарати за хімічною будовою схожі на ПАБК. Вони використовуються мікробною клітиною замість ПАБК і тим самим порушують в ній хід обмінних процесів. Сульфаніламіди мають бактеріостатичну дію.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1763; Нарушение авторских прав?; Мы поможем в написании вашей работы!