
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Бензоатна кислота Acidum benzoicum
|
|
|
|
Кислота бензойна.
Загальна характеристика ароматичних кислот.
Натрію бензоат.
Кислота саліцилова.
Натрію саліцилат.
Кислота ацетилсаліцилова.
Карбонові кислоти ароматичного ряду, як і кислоти жирного ряду, характеризуються наявністю в молекулі карбоксильної групи:
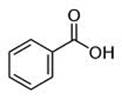
Введення різних функціональних груп в молекулу бензойної кислоти обумовлює різноманітність ароматичних кислот.
Ароматичні кислоти – це кристалічні речовини, малорозчинні у воді і добре у бензолі, спирті, СНCL3.
Загальною реакцією ідентифікації на -СООН є реакція з розчинами солей важких металів (СuSO4, CaCL2, FeCL3, Pb(CH3COO)2), утворюються осади різних кольорів з FeCL3 → комплексна сіль рожево-жовтого кольору (в нейтральному середовищі).
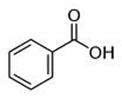
C6Н5СООН
М=122,12
Невелику кількість бензоатної кислоти добувають шляхом перегонки бензойної смоли (Rezina Benzoe). Основним джерелом добування бензоатної кислоти є толуол, який оксидують манган ІV – оксидом (або калій пірохроматом при наявності сульфатної кислоти)
C6Н5·· СН3+3MnO2+3Н2SO4=C6Н5СООН+3MnSO4+4Н2О
Можна толуол також хлорувати при температурі кипіння та яскравому освітленні (фотохімічна реакція) і одержаний бензолтрихлорид омилювати вапняною водою:
C6Н5··СН3+3CІ2=C6Н5··ССІ3+3НСІ
2C6Н5··ССІ3+4Са(ОН)2=(C6Н5СОО)2Са+3СаСІ2+4Н2О
В результаті чого утворюється бензоатна кислота, яку відфільтровують та перекристалізовують з води:
(C6Н5СОО)2Са+2НСІ=2C6Н5СООН+СаСІ2
Бензоатна кислота— бебарвніголчастi кристали або бiлийдрібнокристалiчнiiй порошок. розчинний в 400 ч.холодної та 25ч. к иплячої води. Препарат розчиняється в З ч. спирту тадуже легко розчинний в ефiрi i хлороформi. Летучий з водяноюпарою та легко сублiмує. Топиться при температурi 122—124,5° кипить при 250°. Константа дисоцiацiї дорiвнює 6,0·10(сильнiша від ацетатної кислоти).
Для виявлення бензоатних іонів иейтралiзують препарат роэчином NaОН або амонiаком та додають залiзо ІІІ-хлориду. При цьому спостерiгається утворення осаду основного залiзо-бензоату тiлесного кольору:

При виконуванні реакцiї краще розчин залишити трохикислим вiд бензоатної кислоти, тому що вiльні iони ОН осаджуютьзалiзо ІІІ-гiдроксид.
При змiшуваннi розчину бензоатної кяслоти з перекисом водню та солями тривалентного залiза повiльно виникає фiолетове забарвлення, викликане утворенням салiцилатної кислоти:
С6Н5СООН+Н2О2=НО·С6Н4СООН+Н2О
Щоб виявити фталатну кислоту, як можливу домішку у препараті, проводять реакцiю з резорцином. Кiлькiсне визначення полягає у титруваннi препарату 0,1М розчином NаОН в присутності фенолфталеїну.
Бензоатну кислоту застосовують) зовнішньо як антисептичний засіб (наприклад при мікозах).
Натрій бензоат
(рос. бензоат натрия, бензойнокислий натрий,
 лат. Natrium benzoicum.
лат. Natrium benzoicum.
Натрiй-бензоат добувають розчиненням бензоатної кислоти в гарячому розчині соди.
2С6Н5СООН+Na2СО3=2С6Н5СООNa+СО2+Н2О
Одержаний роэчин пiдгущують до кристалiзацї, виділені кристали вiдфiльтровують та висушують.
Натрiй-бензоат — бiлий зернистий або кристалiчний порошок солодкувато-солоного смаку. Розчинний в 2 ч. води, в 45 ч. спирту ів 9 ч. глiцерину. Розчини мають слаболужну реакцiю.
1.Крупинка препарату, внесена в газове полум’я, забарвлює його в жовтий колiр(натрiй).
2.I1ри додаваннi до розчину препарату залiзо ІІІ-хлориду випадає осад основного залiзо-бензоату тілесного кольору.
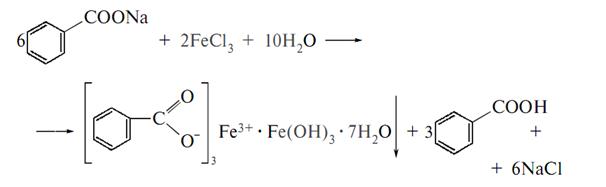
Кiлькiсне визначения полягає у титруваннi препарату 0,5 н. розчином НСI в присутності метилового оранжевого та ефiру:
С6Н5СООNa+НСІ=С6Н5СООН+NaСІ
При титруваннi звільнюється бензоатна кислота, водянi розчини якої мають рН приблизно 2,5—3,0 i можуть впливати на iндикатор. Проте при додаваннi ефiру бензоатна кислота розчиняється в ньому та вилучається, таким чином, з водного середовища.
Натрій-бензоат застосовують як відхаркувальний засіб при бронхітах та інших захворюваннях дихальних шляхів в дозах по 0,2-0,5 г. декілька разів на день. При абсцесі легенів та гнилісному бронхіті вводять 15% розчин препарату інтравенозно. Для дослідження антитоксичної активності печінки вводять хворому 4 г. препарау орально або 1,77 г. інтравенозно в сечі кількість гіпурової кислоти, яка утворюється внаслідок взаємодії бензоатної кислоти з гліцином:
C6Н5СООН+ Н2N·СН2СООН=C6Н5СО·NН·СН2СООН+Н2О
Виділення 65-92,5% натрій-бензоту (при оральному введенні) у вигляді гіпурової кислоти вважається за норму (при інтравенозному введенні – тільки 55,4-79%).
Cаліцилатна кислота Acidum salicylicum

Мм =138,12
Саліцилатна кислота являє собою в хімічному відношенні о-оксибензойну кислоту. Вихідною речовиною для добування саліцилатної кислоти за методом Кольбе, який був вдосконалений Шмідтом, є фенол, який випарюють досуха з еквівалентною кількістю натрій-гідроксиду. Сухий натрій-фенолят нагрівають в автоклавах при температурі 130° з вуглекислим газом:
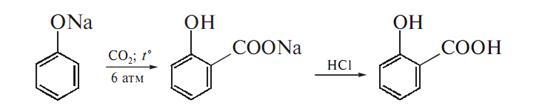
Тому, що вуглекислий газ утворює при низькій температурі з C6Н5ОН сіль складного ефіру C6Н5О·СО·ОNa, раніше вважали цю сіль за проміжний продукт реакції Кольбе. Проте тепер доведено, що СО2 здатний прямо сполучатися з бензольним кільцем. Продукт реакції розчиняють у воді та підкислюють хлоридною кислотою, в результаті чого випадає саліцилатна кислота:
НО·C6Н5СООNa+НСІ=НО·C6Н5СООН+NaСІ
Для очищення препарат перекристалізовують з води.
Саліцилатна кислота – білі дрібні гольчасті кристали або легкий кристалічний порошок солодкувато-кислого смаку. Розчиняється в 500 ч. холодної та в 15 ч. киплячої води, в 3 ч. спирту і в 2 ч. ефіру. Топиться при температурі 159°, кипить при 211°. При повільному нагріванні сублімує: сильне нагрівання веде до утворення фенолу (пізнати по запаху) та вуглекислого газу:
НО·C6Н4СООН=C6Н5ОН+СО2
Одночасно утворюється салол за реакцією:
НО·C6Н4СООН+C6Н5ОН=НО·C6Н4СОО·C6Н5+Н2О
Саліцилатна кислота є значно сильнішою від бензоатної, п-оксибензоатної і м-оксибензоатної кислоти.
Її константа дисоціації дорівнює 1,06·10-3 За Паулінгом це явище зв’язане з утворюванням молекулою саліцилатної кислоти водневого зв’язку і нового шестичленного кільця. Водневий зв’язок разом з гідроксильною групою здатні частково насичувати притягання протону до карбоксильного іону.
При змішанні препарату з формаліном, концентрованою сульфатною кислотою і амоній-ванадатом утворюється синє забарвлення, яке переходить в зелене. З залізом ІІІ-хлоридом саліцилатна кислота дає фіолетове забарвлення не тільки у водному, але і в спиртовому розчинні (на відміну від фенолу). В залежності від кількісного взаємовідношення реагуючих речовин можуть утворюватись різні сполуки. При надлишку залізо ІІІ-хлориду реакція проходить у такий спосіб:


Кількісне визначення полягає у титруванні спиртового розчину NaОН при наявності фенолфталеїну рН 0,1М розчину натрій-саліцилату дорівнює приблизно 8, і тому титрувати можна з фенолфталеїном (змінює забарвлення в межах рН 8,2-10,0). Броматометричне визначення саліцилатної кислоти полягає в утворенні з бромом трибромфенолу, при чому кількість брому, що не ввійшла в реакцію, встановлюють йодометрично:
КВrО3+5КВr+3Н2SO4=3Вr2+3К2SO4+3Н2О
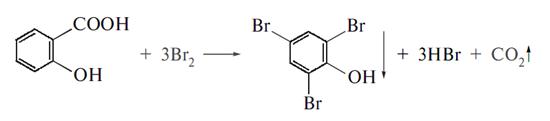
Вr2+2KJ=J2+2KВr
J2+2Na2S2O3=2NaJ+Na2S4O6
Саліцилатну кислоту застосовують як антисептичний, відтяжний, подразний та кератолітичний засіб в 2-5% та 1-10% мазях, пастах і спиртових розчинах. Входить в склад «мозольної рідини», мозольного пластиру, „гальманіну” і пасти «Лассара”.
Натрій-саліцилат Natrium salicilicum
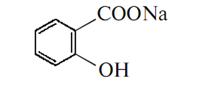
Мм =160,11
Натрій-саліцилат добувають випарюванням розчину саліцилатної кислоти, нейтралізованої еквівалентною кількістю натрій-бікарбонату, досуха:
НО·C6Н4СООН+NаНСО3=НО·C6Н4СООNа+Н2О+СО2
Залишок перекресталізовують в спирт.
Натрій-саліцилат – білий кристалічний порошок або дрібні лусочки солодкувато-солоного смаку. Розчинний в 1 ч. води, в 6 ч. спирту і в 5 ч. гліцерину. При підкисленні концентрованих водних розчинів препарату хлоридною кислотою випадає білий осад саліцилатної кислоти (розчинність у воді – 1:500):
НО·C6Н4СООNа+НСІ= НО·C6Н4СООН+NаСІ
Ідентичність:
1.Крупинка препарату, внесена в газове полум’я, забарвлює його в жовтий колір (натрій).
2.При додаванні до розчину препарату залізо ІІІ-хлориду виникає фіолетове забарвлення:

Кількісне визначення:
Натрій-саліцилат визначають кількісно броматометрично. Через те, що броматометричні визначення проводять в кислому середовищі, реакція проходить ідентично як у випадку вільної саліцилатної кислоти.
Натрій-саліцелат має анальгезуючі, жарознижуючі та протизапальні властивості. Він стимулює гіпофіз та кору надниркової залози, викликаючи збільшення вмісту в крові 17-оксикортикортикостероїдів. Застосовується при ревматизмі,
неревматичних артритах, ексудативному плевриті, невралгіях, міалгіях, хореї, головних болях, тощо. Дози по 0,5-1 г. При гострому ревматизмі та ревматичному ендокартиді можна вводити масові дози до 8-10 г. орально в день або 10 мл. 10-15% розчину інтравенозно.
КИСЛОТА АЦЕТИЛСАЛІЦИЛОВА
Acidum acetylsalicylicum

С9Н8О4 М.м. 180.1
Ацетилсаліцилова кислота (аспірін) є складним ефіром саліцилової та оцтової кислот. Добувається шляхом взаємодії сублімованої саліцилової кислоти з оцтовим ангідридом при нагріванні до 50-60°:

Препарат являє собою безбарвні кристали або білий кристалічний порошок з слабким запахом, слабкого смаку. Мало розчинний у воді, добре - в спирті, розчинний в хлороформі, ефірі в розчинах їдких та вуглекислих лугів.
Ацетилсаліцилова кислота часто має запах оцтової кислоти що обумовлено неправильним її зберіганням (під впливом вологого повітря вона гідролізується з виділенням оцтової і саліцилової кислот)
Ідентичність препарату встановлюють по продуктам омилення. Так, після кип’ятіння препарату з розчином їдкого натрію і при послідуючому підкисленні реакційної суміші виділяється білий осад саліцилової кислоти.
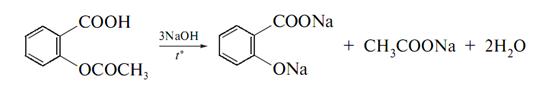
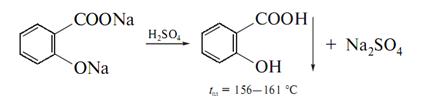
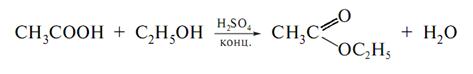 Фільтрат до якого входить оцтова кислота, добавляють етиловий спирт – виникає запах оцтовоетилового ефіру:
Фільтрат до якого входить оцтова кислота, добавляють етиловий спирт – виникає запах оцтовоетилового ефіру:
До осаду (саліцилова кислота) додають розчин FeCL3 – спостерігається синьо-фіолетове забарвлення. Саліцилову кислоту можна підтвердити і додаванням формаліну (рожеве забарвлення).
В препараті допускаються добавки хлоридів в сульфатів в рамках еталону.
Проводиться також випробування на вільну саліцилову кислоту вміст якої в препараті дозволяється ДФХ в межах еталону.
Кількісний вміст ацетилсаліцилової кислоти в препараті може визначатись різними способами:
1. Нейтралізацією по вільній карбоксильній групі (фармакопейний метод):

Титрування проводиться в спиртовому середовищі (для уникнення гідролізу) при індикаторі фенолфталеїн. Грам-еквівалент в цьому випадку рівний молекулярній масі препарату.
2. Омиленням з наступним титруванням надлишка лугу кислотою по метил-оранжевому.
Грам-еквівалент в даному випадку дорівнює М.м /2
3. Бромування продукту омилення ацетилсаліцилової кислоти – саліцилату натрію з наступним перерахунком на препарат (метод Кольтгофа).
В шлунку ацетилсаліцилова кислота не змінюється, а в кишечнику під впливом лужного середовища розпадається з утворенням саліцилової і оцтової кислот; частково препарат всмоктується незмінним.
Застосовується як протиревматичний, протизапальний, жаро- знижуючий та болезаспокійливий засіб при невралгії, головних болях, грипі разом з іншими препаратами. З деякими речовинами основного характеру (гексаметилентетрамін, двовуглекислі луги) ацетилсаліцилова кислота дає легко відсиріваючі суміші, що необхідно враховувати при виписуванні рецепта з подібними речовинами.
Зберігати в сухому місці, та добре закупорених банках.
ЛЕКЦІЯ № 11-12
Тема: Лікарські засоби - похідні ароматичних амінів.
ПЛАН
1. Загальна характеристика ароматичних амінів.
2. Похідні аніліну. Парацетамол.
3. Загальна характеристика амідів сульфанілової кислоти.
4. Сульфаніламідні лікарські засоби: стрептоцид, сульфацил- натрій, норсульфазол, сульфадимезин, фталазол сульфадиметоксин, сульфален.
Найпростішим аміном ароматичного ряду є анілін, який має здатність знижувати температуру тіла, але внаслідок своєї токсичності в медичній практиці не застосовується.
Як жарознижувальний засіб застосовується ацетанілід (антифебрин). Він менш токсичний, але при тривалому застосуванні також спричиняє отруєння:
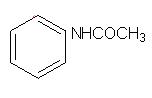
Встановлено, що анілін, який утворюється в результаті гідролізу ацетаніліду, окиснюється в організмі до п-амінофенолу. Таке окислення можна розглядати як захисну реакцію, оскільки п-амінофенол менш токсичний і порівняно легко виводиться з організму.

У результаті вивчення фармакологічної дії похідних п-амінофенолу було синтезовано малотоксичні лікарські засоби парацетамол і фенацетин. Створення нових лікарських засобів на основі дослідження продуктів перетворення аніліну в організмі відомо під назвою «принцип фенацетину». За цим принципом створюються нові синтетичні лікарські речовини в різних класах органічних сполук.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 4218; Нарушение авторских прав?; Мы поможем в написании вашей работы!