
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительное титрование. Пример 18 поможет Вам при решении задач № 198, 203, 204, 207, 209, 212, 213
|
|
|
|
Пример 18 поможет Вам при решении задач № 198, 203, 204, 207, 209, 212, 213.
Пример 18. К 20,00 мл раствора соли серебра добавили 20,00 мл 0,0200 моль/л раствора K2CrO4. Осадок Ag2CrO4 отделили, а фильтрат подкислили, добавили избыток раствора КI. На титрование выделившегося иода пошло 24,60 мл 0,0400 моль/л раствора Na2S2O3. Рассчитать массовую концентрацию Ag+ в исходном растворе.
Решение. Запишем уравнения реакций:
2Ag+ + 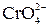 (изб.) = Ag2CrO4 ↓ (13)
(изб.) = Ag2CrO4 ↓ (13)
2  + 6 I– + 16 H+ D 2 Cr3+ + 3 I2 + 8 H2O (14)
+ 6 I– + 16 H+ D 2 Cr3+ + 3 I2 + 8 H2O (14)
2 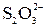 + I2 D
+ I2 D  + 2 I (15)
+ 2 I (15)
При количественном определении Ag+ последовательно используются методы обратного титрования и титрования заместителя.
Фактор эквивалентности иона  в реакции окисления-восстановления (14) определяем, используя полуреакцию
в реакции окисления-восстановления (14) определяем, используя полуреакцию
 + 8 H+ – 3ē = Cr3+ + 4 H2O → fэкв(
+ 8 H+ – 3ē = Cr3+ + 4 H2O → fэкв( )= 1/3.
)= 1/3.
По реакции (13) два иона Ag+ вступают в реакцию осаждения с ионом  , следовательно, 2 иона Ag+ эквивалентны 3 электронам. Для определения фактора эквивалентности иона Ag+ составим пропорцию:
, следовательно, 2 иона Ag+ эквивалентны 3 электронам. Для определения фактора эквивалентности иона Ag+ составим пропорцию:
2 иона Ag+ – 3 ē
1 ион Ag+ – х ē
Отсюда x = z = 3/2. Следовательно фактор эквивалентности иона Ag+ равен 2/3.
Перейдем от молярных концентраций растворов к молярным концентрациям эквивалента:
с(1/3K2CrO4) = 0,0200 / (1/3) = 0,0600 моль/л;
с(1Na2S2O3) = 0,0400 / 1 = 0,0400 моль/л.
Дальше задачу можно решать двумя путями: 1) по формулам подраздела 6.3 с расчетом количеств молей эквивалента реагирующих веществ; 2) путем расчета объема избытка реагента. Предлагаем второй вариант.
По закону эквивалентов найдем объем раствора K2CrO4, который остался после реакции (13):
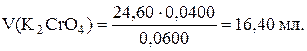
Тогда на реакцию (14) ушло 20,00 – 16,40 = 3,60 мл раствора K2CrO4.
Найдем массу Ag+в растворе. Т. к. М(2/3Ag+) = 71,912 г/моль, то
m(Ag2+) = 3,60 ∙ 10–3 ∙ 0,0600 ∙ 71,912 = 0,01553 г,
и его массовую концентрацию:
ρ*(Ag+) = 0,01553 /20 ∙ 10–3 = 0,7766 г/л.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1022; Нарушение авторских прав?; Мы поможем в написании вашей работы!