
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительное титрование
|
|
|
|
Пример 22 поможет Вам при решении задач №187–194.
Пример 22. Построить кривую титрования I2 раствором аскорбиновой кислоты (C6H8O6) и подобрать индикаторы. Концентрации растворов: С (1/2 I2) = 0,02 моль/л, С (1/2 C6H8O6) = 0,01 моль/л. рН раствора = 1.
Решение. Кривые окислительно-восстановительного титрования отражают зависимость потенциала системы от объема прибавленного реагента. При титровании раствора иода раствором аскорбиновой кислоты протекает окислительно-восстановительная реакция:
I2 + 2ē D 2I– I2 – окислитель
C6H8O6– – 2ē D C6H6O6 +2Н+ C6H8O6 – восстановитель
I2 + C6H8O6 = 2I– + 2 Н+ + C6H6O6
В растворе образуются две окислительно-восстановительные пары: I2 / 2I– и C6H8O6/C6H6O6, потенциал каждой из которых можно рассчитать по уравнению Нернста:
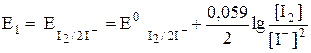
| (16) |

| (17) |
Значения стандартных потенциалов находим в справочнике [3]:
 = + 0,536 В;
= + 0,536 В;  = – 0,326 В.
= – 0,326 В.
Рассчитаем объем (VT) раствора C6H8O6, необходимый для оттитровывания 100 мл (V0) раствора I2:
С0 · V0 = СT · VT; VT = 0,02 · 100,00/ 0,01 = 200,00 мл.
Потенциал системы до начала титрования не рассчитывают, поскольку в исходном растворе известна концентрация только одной из сопряженных форм титруемого вещества. До т. э. расчет потенциала удобнее вести по уравнению (16), а после т. э. – по уравнению (17).
1. Расчет кривой до т. э.
В результате прибавления 100,00 мл раствора аскорбиновой кислоты образовалось эквивалентное количество I– – иона, так как из одного моля I2 образовалось два моля I–, то есть коэффициенты перед окисленной и восстановленной формами различны, то при расчете концентраций будем учитывать разбавление.

Рассчитаем концентрацию неоттитрованного иода:

Для подстановки в уравнение Нернста концентрацию необходимо перевести в молярную:
[I2] = 2,50 · 10–3 моль/л.
По формуле (17) рассчитываем потенциал системы:

После добавления 180,00 мл (90%) титранта, рассчитаем изменившиеся концентрации иодид-иона и иода, а также потенциал системы:


[I2] = 3,57 · 10–4 моль/л;

Прибавлено 198,00 мл (99%) раствора аскорбиновой кислоты:


[I2] = 3,35 · 10–5 моль/л, Е = +0,532 В.
Прибавлено 199,80 мл раствора аскорбиновой кислоты (99,9%). Точка начала скачка титрования соответствует моменту титрования, когда раствор недотитрован на 0,1%:


[I2] = 3,34 · 10–6 моль/л, Е = +0,503 В.
2. Потенциал системы в т. э. рассчитываем с учетом рН раствора по формуле
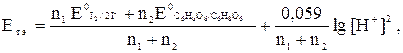
где n1 и n2 – количество электронов, участвующих в полуреакциях.
 .
.
3. Расчет кривой после т. э. проводим по формуле (17).
Прибавлено 200,20 мл раствора аскорбиновой кислоты (100,1 %), то есть раствор иода перетитрован на 0,1%, что соответствует концу скачка титрования. Определим концентрацию избытка аскорбиновой кислоты:

Молярная концентрация С6Н8О6:
[С6Н8О6] = 3,33 · 10–6 моль/л.
Количество образовавшегося продукта окисления аскорбиновой кислоты (С6Н6О6) после т. э. не изменяется, а его концентрация уменьшается с разбавлением:
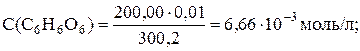
[С6Н6О6] = 3,33 · 10–3 моль/л.
Рассчитаем потенциал системы Е:

При добавлении 202,00 мл титранта (101%):
[С6Н8О6] = 3,31 · 10–5 моль/л;
[С6Н6О6] = 3,31 · 10–3 моль/л;
Е = –0,326 В.
При добавлении 220,00 мл титранта (110%):
[С6Н8О6] = 3,12 · 10–4 моль/л;
[С6Н6О6] = 3,12 · 10–3 моль/л;
Е = –0,356 В.
4. Результаты вычислений сведем в табл. 3, а по данным таблицы построим кривую титрования (рис. 3).
Таблица 3
| Объем прибавленного титранта, мл | Потенциалопределяющая система | Е, В |
| 100,00 | I2 / 2 I– | 0,595 |
| 180,00 | I2 / 2 I– | 0,564 |
| 198,00 | I2 / 2 I– | 0,532 |
| 199,80 | I2 / 2 I– | 0,503 |
| 200,00 | I2 C6H6O6 | 0,075 |
| 200,20 | C6H8O6/C6H6O6 | –0,296 |
| 202,00 | C6H8O6/C6H6O6 | –0,326 |
| 220,00 | C6H8O6/C6H6O6 | –0,356 |

Рис. 3. Кривая титрования раствора иода раствором аскорбиновой кислоты [С (1/2I2) = 0,02 моль/л, С (1/2 C6H8O6) = 0,01 моль/л]
В качестве окислительно-восстановительных индикаторов можно использовать нейтральный красный (при рН=1 Е0= + 0,15В), индиготрисульфоновую и индиготетрасульфоновую кислоты (при рН=1 соответственно Е0 = +0,28 и +0,31 В). Значения Е0 этих индикаторов находятся в пределах скачка титрования.
ЛИТЕРАТУРА
1. Аналитическая химия: Программа, методические указания и контрольные задания по одноименному курсу для студентов-заочников химико-технологических специальностей / Н. А. Коваленко, А. Е. Соколовский, Е. В. Радион. – Мн.: БГТУ, 2001.
2. Методические указания по курсу «Аналитическая химия» для студентов химико-технологических специальностей / В. А. Якубович, О. Н. Чудновская, Т. Л. Залевская и др. – Мн.: БТИ, 1987.
3. Лурье Ю. Ю. Справочник по аналитической химии.– М.: Химия, 1989.
4. Васильев В. П. Аналитическая химия: В 2 т. Т. 1. – М.: Высшая школа, 1989.
СОДЕРЖАНИЕ
| Введение............................................ Контрольная работа № 1 | |
| 1. Равновесие в системе осадок - раствор.................... 1.1. Расчет ПР по растворимости......................... 1.2. Расчет растворимости осадков в воде.................. 1.3. Задачи на применение условия выпадения осадка....... 1.4. Расчет растворимости осадков в присутствии одноименных ионов.......................................... 1.5. Расчет растворимости осадка в присутствии разноименных ионов (солевой эффект).......................... 2. Кислотно-основное равновесие........................... 2.1. Расчет рН раствора по известным равновесным концентрациям растворенных веществ........................ 3. Окислительно-восстановительное равновесие............... 3.1. Расчет констант равновесия окислительно- восстановительных реакций.......................... 3.2. Расчет окислительно-восстановительного потенциала 4. Реакции комплексообразования........................... 4.1. Расчет равновесных концентраций ионов............... Контрольная работа № 2 5. Гравиметрический метод анализа......................... 5.1. Расчет результатов гравиметрического анализа.......... 5.2. Расчет количества осадителя.......................... 5.3. Расчет потерь осадка при промывании................. 6. Титриметрические методы анализа........................ 6.1. Способы выражения концентраций.................... 6.2. Определение фактора эквивалентности................. 6.3. Способы титрования................................ 7. Расчеты результатов титриметрического анализа............ 7.1. Кислотно-основное титрование........................ 7.2. Окислительно-восстановительное титрование............ 7.3. Комплексонометрическое титрование................... 8. Построение кривых титрования........................... 8.1. Титрование сильных кислот и оснований................ 8.2. Титрование слабой кислоты сильным основанием........ 8.3. Окислительно-восстановительное титрование........... Литература............................................... |
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1287; Нарушение авторских прав?; Мы поможем в написании вашей работы!