
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Титрование сильных кислот и оснований
|
|
|
|
ПОСТРОЕНИЕ КРИВЫХ ТИТРОВАНИЯ
Комплексонометрическое титрование
Пример 19 поможет Вам при решении задач № 225, 226, 230, 232, 234, 236, 243, 244.
Пример 19. Вычислить массовую долю Al2O3 в силикате, если навеску 1,0220 г перевели в раствор, добавили 25,00 мл раствора комплексона III [C(1/2 компл. III) = 0,2151 моль/л ], а на титрование избытка последнего пошло 9,83 мл 0,1015 моль/л раствора сульфата цинка.
Решение. В растворе протекают следующие реакции:
Al3+ + H2Y2– D AlY– + 2 H+
H2Y2– + Zn2+ D ZnY2– + 2 H+
Расчеты в задаче будем проводить по методу обратного титрования (см. подраздел 6.3). Количество молей эквивалента Al3+ определяется разностью:
n(1/2 Al3+) = n(1/2 компл. III) – n(1/2 ZnSO4).
Рассчитаем количество молей эквивалента прибавленного комплексона III:
n(1/2 компл. III) = C(1/2 компл. III) ∙ V(1/2 компл. III);
n(1/2 компл. III) = 0,2151 ∙ 25,00 ∙ 10–3 = 5,38 ∙ 10–3 моль.
Переведем концентрацию раствора ZnSO4 в молярную концентрацию эквивалента ZnSO4 с учетом, что fэкв.(ZnSO4) = 1/2 (см. подраздел 6.2):
С (1/2 ZnSO4) = С (ZnSO4): 1/2 = 0,1015: 1/2 = 0,2030 моль/л;
n(1/2 ZnSO4) = 0,2030 ∙ 9,83 ∙ 10–3 = 2,00 ∙ 10–3 моль.
Тогда количество молей эквивалента Al3+
n(1/2 Al3+) = 5,38 ∙ 10–3 – 2,00 ∙ 10–3 = 3,38 · 10–3 моль.
Вычислим fэкв.(Al2O3) с учетом схемы:
Al2O3 → 2 Al3+
fэкв. (Al2O3) = (1/2)/ 2 = 1/4.
Рассчитаем m(Al2O3) с учетом M(1/4 Al2O3) = 25,4903:
m(Al2O3) = n(1/2 Al3+) ∙ M(1/4 Al2O3) = 3,38 ∙ 10–3 ∙ 25,4903 = = 0,0862 г;
ω = 0,0862 / 1,0220 ∙ 100 = 8,43 %.
Кривые титрования помогают выбрать индикатор, оценить погрешность титрования, наглядно проследить за ходом титрования. В процессе кислотно-основного титрования изменяется рН раствора, поэтому кривые титрования строят в координатах рН – V или рН – f, где V – объем прибавляемого титранта (мл), f – степень оттитрованности (%).
Кривые окислительно-восстановительного титрования строят в координатах – потенциал системы (Е) от объема (V) прибавленного реагента.
При построении кривой титрования необходимо провести расчеты величины рН или Е для четырех этапов титрования:
1) до начала титрования (исключается в случае окислительно-восстановительного титрования);
2) до точки эквивалентности;
3) в точке эквивалентности;
4) после точки эквивалентности.
В расчетах с использованием закона эквивалентов применяется молярная концентрация эквивалента, которую необходимо перевести в молярную концентрацию перед подстановкой в формулы для расчета рН или Е. Формулы приведены в разделах 2 и 3.
Пример 20 поможет Вам при решении задач № 142,144–146.
Пример 20. Построить кривую титрования NaOH [С(NaOH) = = 0,15 моль/л] раствором HCl c концентрацией 0,30 моль/л и подобрать индикаторы.
Решение. NaOH – сильное основание, а HCl – сильная кислота, поэтому в данном случае рассмотрим титрование сильного основания сильной кислотой.
Предположим, что для титрования взяли 100,00 мл (V0) раствора NaOH [С0 = С(NaOH) = 0,15 моль/л]. По закону эквивалентов рассчитаем объем раствора HCl (V х), необходимый для оттитровывания NaOH (для достижения т. э):
100,00 · 0,15 = V х · 0,30; V х = 50,00 мл.
Для простоты расчета допустим, что объем раствора при титровании не изменяется.
1. Сильные кислоты и основания в водном растворе диссоциированы нацело, поэтому концентрацию Н+ или рН рассчитывают, исходя из концентрации NaOH по уравнению (3).
pH = 14 – pOH = 14+lg 0,15 = 13,18.
2. Значения рН раствора до точки эквивалентности будут определяться концентрацией неоттитрованного основания. При прибавлении 25,00 мл (50%) раствора HCl на титрование затрачено n(HCl) = = 25,00 · 10–3 · 0,30 = 7,50 · 10–3 моль. Неоттитрованное количество NaOH определяется вычитанием эквивалентного количества от исходного:
100,00 · 10–3 · 0,15 – 7,50 · 10–3 = 7,50 · 10–3 моль.
Отсюда С(NaOH) = 7,50 ∙ 10–3/100,00 ∙ 10–3 = 7,50 ∙ 10–2 моль/л, а
рН = 14 + lg 7,50 ∙ 10–2 = 12,88.
Объединяя поэтапный расчет и учитывая, что молярные концентрации эквивалентов в данном случае равны молярным концентрациям, получим в общем виде:
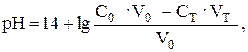
где Ст и С0 – исходные концентрации растворов титранта и титруемого вещества соответственно; V0 – исходный объем титруемого вещества; Vт – добавленный объем титранта.
Таким же образом рассчитываем рН при прибавлении 45,00 мл раствора HCl (45,00: 50,00 · 100 = 90%):
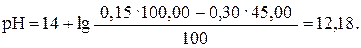
Если добавлено 49,50 мл раствора HCl (49,50: 50,00 · 100 = = 99%), то
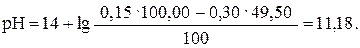
После прибавления 49,95 мл раствора HCl (49,95: 50,00 · 100 = = 99,9%):
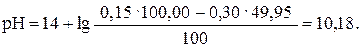
3. В точке эквивалентности рН раствора определяется автопротолизом воды, рН = 1/2 рКW = 7.
За точкой эквивалентности рН определяется избытком НCl. При добавлении 50,05 мл раствора HCl (50,05: 50,00 · 100 = 100,1 %):
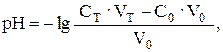
а так как в точке эквивалентности количество моль титруемого вещества равно количеству моль титранта, то есть С0 ∙ V0= 100,00 · 0,15 = = 50,00 ∙ 0,30, то:

При добавлении 50,50 мл раствора HCl (50,50: 50,00 · 100 = = 101 %):
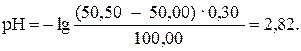
При добавлении 55,00 мл раствора HCl (55,00: 50,00 · 100 = = 110 %):

Результаты вычислений сведем в табл. 1, а по данным таблицы построим кривую титрования (рис. 1).
Таблица 1
| Объем титранта VT, мл | рН-определяющий компонент | Формула для расчета рН | рН |
| NaOH | 14+lg С0(NaOH) | 13,18 | |
| 25,00 | NaOH | 
| 12,88 |
| 45,00 | NaOH | -″- | 12,18 |
| 49,50 | NaOH | -″- | 11,18 |
| 49,95 | NaOH | -″- | 10,18 |
| 50,00 | H2O | рН = 1/2 рКW | 7,00 |
| 50,05 | HCl | 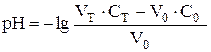
| 3,82 |
| 50,50 | HCl | -″- | 2,82 |
| 55,00 | HCl | -″- | 1,82 |
Скачок титрования определяется резким изменением рН от 10,18 до 3,82 при недотитровывании или перетитровывании на 0,1% соответственно. Правило выбора индикаторов предусматривает, что интервал перехода окраски индикатора должен укладываться в скачок титрования. Используя справочные данные по интервалу перехода окраски индикаторов, предлагаем следующие наиболее часто применяемые индикаторы: метиловый оранжевый (интервал перехода 3,1–4,4; рТ=4,0), метиловый красный (интервал перехода 4,2–6,2; рТ=5,0), бромтимоловый синий (интервал перехода 6,0–7,6; рТ=7,0), фенолфталеин (интервал перехода 8,2–10,0; рТ=9,0).

Рис. 1. Кривая титрования 0,15 моль/л раствора гидроксида натрия 0,30 моль/л раствором соляной кислоты
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 2381; Нарушение авторских прав?; Мы поможем в написании вашей работы!