
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет количества осадителя
|
|
|
|
Расчет результатов гравиметрического анализа
Пример 14 поможет Вам при решении задач № 1–50.
Пример 14. Рассчитать массовую долю (%) серебра в сплаве, если для анализа взята навеска m1 = 0,4368 г, которая переведена в раствор (V1=300 мл), а из аликвоты (V2 = 125 мл) получено m2 = 0,0958 г Ag2CrO4.
Решение. Массовая доля серебра рассчитывается по формуле
w = m (Ag)/m1 · 100%.
Для определения m (Ag) запишем схему анализа и установим стехиометрические соотношения между соединениями:
2 Ag ® Ag2CrO4.
Рассчитаем гравиметрический фактор F по формуле (12):
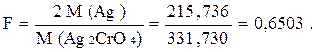
Массу серебра определим следующим образом:
m′(Ag) = m(гравиметр. формы) ∙ F = 0,0958 · 0,6503 = 0,0623 г;
0,0623 г Ag содержится в 125 мл раствора;
х г Ag содержится в 300 мл раствора,
тогда полное содержание Ag рассчитаем по формуле
m(Ag) = m′(Ag) ∙ V1/V2 = 0,0623 ∙ 300/125 = 0,1495 г.
Отсюда массовая доля серебра в сплаве
w = (0,1495/0,4368) ∙ 100% = 34,23%.
Пример 15 поможет Вам при решении задач № 51–66.
Пример 15. Какой объем 4 %-ного раствора Na2HPO4 необходим для практически полного осаждения Mn2+ из раствора, содержащего 0,6452 г MnSO4 · 4H2O?
Решение. Запишем реакцию осаждения:
2MnSO4 + (NH4)2SO4 + 2Na2HPO4 ® 2MnNH4PO4¯ + 2Na2SO4 + H2SO4
В соответствии со стехиометрией реакции рассчитаем необходимую массу Na2HPO4:
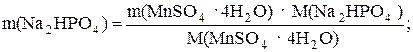
m(Na2HPO4) = 0,6452 ∙ 141,96 / 223,06 = 0,4106 г.
Рассчитаем массу 4 %-ного раствора Na2HPO4:
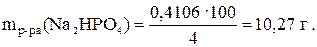
Принимая плотность раствора Na2HPO4 равной единице, так как w<5%, находим необходимый объем осадителя:
Vр-ра (Na2HPO4) = 10,27 мл.
Поскольку осадитель нелетучий, то для практически полного осаждения необходимо взять его полуторакратный избыток, т. е.
10,27 ∙ 1,5 = 15,40 мл.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1823; Нарушение авторских прав?; Мы поможем в написании вашей работы!