
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет окислительно-восстановительного потенциала
|
|
|
|
Окислительно-восстановительных реакций
Расчет констант равновесия
Пример 10 поможет Вам при решении задач № 101–125.
Пример 10. Вычислить константу равновесия окислительно-восстановительной реакции 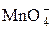 +
+ 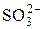 + H+ = Mn2+ +
+ H+ = Mn2+ + 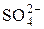 + H2O и сделать вывод о ее направлении.
+ H2O и сделать вывод о ее направлении.
Решение. Запишем уравнения полуреакций:
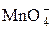 + 8H+ + 5ē = Mn2+ + 4H2O
+ 8H+ + 5ē = Mn2+ + 4H2O
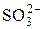 + H2O – 2ē =
+ H2O – 2ē = 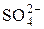 + 2H+
+ 2H+
Запишем суммарное уравнение:
2 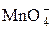 + 5
+ 5 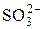 + 16H+ = 2Mn2+ +5
+ 16H+ = 2Mn2+ +5 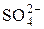 + 8H2O
+ 8H2O
Находим по таблице [3] стандартные окислительно–восстановительные потенциалы: 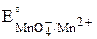 = +1,51 В,
= +1,51 В, 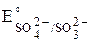 =
=
= + 0,17 В. Число электронов, участвующих в реакции, n = 2 ∙ 5 =10.
Рассчитаем константу равновесия:
lg K = ΔE◦ ∙ n/0,059 = (1,51 – 0,17) ∙ 10 / 0,059 =231,0,
K = 10231>> 1.
Следовательно, реакция будет протекать в прямом направлении.
Последовательность действий, необходимых для решения задач № 126–135, приведена в методических указаниях [1].
Пример 11 поможет Вам при решении задач № 126–135.
Пример 11. Вычислить окислительно-восстановительный потенциал, если к 15,0 мл 0,20 М раствора KMnO4 добавили 50,0 мл 0,10 М раствора Na2SO3 при рН = 1.
Решение. При смешении растворов протекает реакция (см. пример 10). Потенциал раствора после смешения будет определяться веществом, которое находится в избытке. Рассчитаем количество вещества (моль-экв) в обоих растворах:
n(1/5KMnO4) = 15,0 ∙ 10–3∙ 0,20 ∙ 5= 15,0 ∙ 10–3 моль-экв;
n(1/2Na2SO3) = 50,0 ∙ 10–3 ∙ 0,10 ∙ 2 = 10,0 ∙ 10–3 моль-экв.
В избытке находится KMnO4. После протекания реакции в растворе будет содержаться
n(1/5 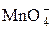 ) = 15,0 ∙ 10–3 – 10,0 ∙ 10–3 =5,0 ∙ 10–3моль-экв →
) = 15,0 ∙ 10–3 – 10,0 ∙ 10–3 =5,0 ∙ 10–3моль-экв →
n(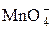 ) = 1,0 ∙ 10–3моль.
) = 1,0 ∙ 10–3моль.
n(1/5 Mn2+) = 10,0 ∙ 10–3 моль-экв → n(Mn2+) =2,0 ∙ 10–3моль.
Объем раствора после смешения составит 15,0 + 50,0 = 65,0 мл = = 65 ∙ 10–3 л.
Рассчитаем концентрации ионов:
С(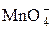 ) =1,0 ∙ 10–3/65 ∙ 10–3 = 0,0154 моль/л.
) =1,0 ∙ 10–3/65 ∙ 10–3 = 0,0154 моль/л.
С(Mn2+) =2,0 ∙ 10–3/65 ∙ 10–3 = 0,0308 моль/л.
C(H+) = 10–pH = 10–1 = 0,1 моль/л.
Рассчитаем окислительно–восстановительный потенциал раствора:
E = 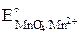 + 0,059/5 ∙ lg (
+ 0,059/5 ∙ lg (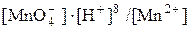 ) =
) = 
= 1,51 + 0,059/5 ∙ lg(0,0154 ∙ (0,1)8/ 0,0308) = 1,49 В.
Особенностью задач № 136–142 является наличие конкурирующих реакций окисления-восстановления и осаждения, поэтому при расчете окислительно-восстановительных потенциалов учитывается ПР малорастворимого соединения. Кроме того, ионы Cu2+,Cu+ и Ag+ образуют с ионами SCN–, Cl–, Br– и I– не только малорастворимые, но и комплексные соединения, что иногда вызывает трудности у студентов. По условиям задач № 136–142 концентрация анионов достаточно мала, и равновесие комплексообразования практически не влияет на концентрации катионов. Поэтому учитывать комплексообразование в этих задачах не нужно. Однако при желании Вы можете провести расчеты с учетом конкурирующей реакции комплексообразования. Примеры таких расчетов Вы найдете в литературе [4].
Пример 12 поможет Вам при решении задач № 136–142.
Пример 12. Вычислить окислительно-восстановительный потенциал пары 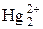 /Hg в присутствии ионов Cl–, приняв концентрацию ионов Cl– равной 0,1 моль/л.
/Hg в присутствии ионов Cl–, приняв концентрацию ионов Cl– равной 0,1 моль/л.
Решение. В присутствии ионов Cl– в растворе образуется малорастворимое соединение Hg2Cl2. Полуреакцию Hg2Cl2 + 2e = 2Hg +
+ 2Cl– можно представить как сочетание реакций окисления-восстановления и осаждения:
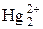 + 2ē = 2Hg
+ 2ē = 2Hg
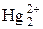 + 2 Cl– = Hg2Cl2
+ 2 Cl– = Hg2Cl2
Найдем по справочнику [3] 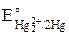 = 0,792 В,
= 0,792 В, 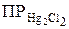 =
=
=1,3∙10–18.
Равновесная концентрация ионов ртути (I) определяется как растворимость Hg2Cl2 при [Cl–] = 0,1 моль/л и составляет:
С(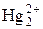 ) =
) = 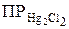 / [Cl–]2 = 1,3 ∙ 10–18/(0,1)2 =1,3 ∙ 10–16 моль/л.
/ [Cl–]2 = 1,3 ∙ 10–18/(0,1)2 =1,3 ∙ 10–16 моль/л.
Отсюда
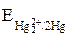 = 0,792 + 0,059/2 ∙ lg 1,3 ∙ 10–16 = 0,323 В.
= 0,792 + 0,059/2 ∙ lg 1,3 ∙ 10–16 = 0,323 В.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 8689; Нарушение авторских прав?; Мы поможем в написании вашей работы!