
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концентрациям растворенных веществ
|
|
|
|
Расчет рН раствора по известным равновесным
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ
Наибольшее признание из всех известных теорий кислот и оснований получила протолитическая теория Бренстеда и Лоури. Согласно этой теории, кислотно-основные реакции осуществляются за счет переноса протона от кислоты к основанию. Иначе говоря, кислота является донором, а основание – акцептором протонов. Существуют также вещества, способные как отдавать, так и принимать протоны. Они называются амфолитами. В водных растворах сильных одноосновных кислот протолитическое равновесие HA + H2O D H3O+ + A– целиком сдвинуто вправо и концентрация ионов водорода совпадает с концентрацией кислоты. Слабые кислоты и основания в водных растворах диссоциированы лишь частично. На основании анализа равновесий в растворах выводятся основные уравнения для расчета рН.
Расчет рН растворов электролитов проводится по следующим (упрощенным) формулам:
сильных одноосновных кислот
pH = – lgCкислоты (1)
слабых кислот
pH = 1/2pKкислоты – 1/2 lgCкислоты (2)
сильных однокислотных оснований
pH = 14 + lgCоснования (3)
слабых оснований
pH = 14 – 1/2pKоснования + 1/2 lgCоснования (4)
солей слабых кислот
pH = 7 + 1/2pKкислоты + 1/2 lgCсоли (5)
солей слабых оснований
pH = 7 – 1/2pKоснования – 1/2 lgCсоли (6)
буферных растворов, образованных слабой кислотой и ее солью (солью слабой кислоты и сильного или слабого основания)
pH = pKкислоты– lg(Cкислоты / Cсоли) (7)
буферных растворов, образованных слабым основанием и ее солью (солью слабого основания и сильной или слабой кислоты)
pH = 14 – pKоснования + lg(Cоснования /Cсоли) (8)
амфолитов (кислых солей)
pH = (pKn + pKn+1)/2 (9)
При решении задач № 51–94, 97 необходимо провести вычисления в следующей последовательности:
– написать уравнение реакции взаимодействия веществ, при необходимости по ступеням;
– перевести концентрации всех веществ в молярные;
– рассчитать количество молей всех веществ;
– на основании полученных данных определить состав раствора после протекания реакции и выбрать уравнение для расчета рН;
– рассчитать объем раствора после смешения;
– рассчитать концентрации веществ в образовавшемся после смешения растворе;
– вычислить рН раствора.
Примеры 8–9 помогут Вам при решении задач № 51–94, 97.
Пример 8. Вычислить рН раствора, полученного при сливании:
а) 20,0 мл 0,12 М раствора NaCN и 15,0 мл 0,09 М раствора HCl.
Решение. Запишем уравнение реакции
NaCN + HCl = HCN + NaCl
С целью выяснения состава раствора, образовавшегося после сливания, рассчитаем количества веществ в исходных растворах:
n0(NaCN) = 20,0 ∙ 10–3 ∙ 0,12 = 2,4 ∙ 10–3 моль;
n0(HCl) = 15,0 ∙ 10–3 ∙ 0,09 = 1,35 ∙ 10–3 моль.
Так как n0(NaCN) > n0(HCl), то NaCN находится в избытке, следовательно, в образовавшемся после сливания растворе будут находиться NaCN и HCN в следующих количествах:
n1(NaCN) = n0(NaCN) – n0(HCl) = 2,4 ∙ 10–3 – 1,35 ∙ 10–3 =
= 1,05 ∙ 10–3 моль.
n1(HCN) = n0(HCl) = 1,35 ∙ 10–3 моль.
Объем раствора (V) составит 20 + 15 = 35 мл.
Рассчитаем концентрации веществ в растворе:
С(NaCN) = 1,05 ∙ 10–3/ 35 ∙ 10–3 = 0,03 моль/л.
С(HCN) = 1,35 ∙ 10–3/ 35 ∙ 10–3 = 0,039 моль/л.
Исходя из состава раствора, выбираем формулу (7) для расчета рН буферных растворов:
pH =  – lg[С(HCN) / С(NaCN)] = 9,3 – lg(0,039/0,03) = 9,18;
– lg[С(HCN) / С(NaCN)] = 9,3 – lg(0,039/0,03) = 9,18;
б) 11,25 мл 0,12 моль/л раствора NaCN и 15,0 мл 0,09 моль/л раствора HCl.
Решение.
n(NaCN) = 11,25 ∙ 10–3 ∙ 0,12 = 1,35 ∙ 10–3 моль.
n(HCl) = 15,0 ∙ 10–3 ∙ 0,09 = 1,35 ∙ 10–3 моль.
Так как n(NaCN) = n(HCl), то в образовавшемся после сливания растворе будет находиться только 1,35 ∙ 10–3 моль HCN.
Объем раствора (V) составит 11,25 + 15,0 = 26,25 мл.
Рассчитаем концентрацию HCN в растворе:
С(HCN) = 1,35 ∙ 10–3/ 26,25 ∙ 10–3 = 0,051 моль/л.
Исходя из состава раствора выбираем формулу (2) для расчета рН слабых кислот:
pH = 1/2  – 1/2 lg[С(HCN)] = 1/2 ∙ 9,3 – 1/2 ∙ lg(0,051) = 5,3;
– 1/2 lg[С(HCN)] = 1/2 ∙ 9,3 – 1/2 ∙ lg(0,051) = 5,3;
в) 20,0 мл 0,12 моль/л раствора NaCN и 35,0 мл 0,09 моль/л раствора HCl.
Решение.
n0(NaCN) = 20,0 ∙ 10–3∙ 0,12 = 2,4 ∙ 10–3 моль.
n0(HCl) = 35,0 ∙ 10–3 ∙ 0,09 = 3,15 ∙ 10–3 моль.
Так как n0(HCl) > n0(NaCN), т. е. в избытке HCl, то в образовавшемся после сливания растворе будут находиться HCl и HCN в следующих количествах:
n1(HCl) = 35,0 ∙ 10–3 ∙ 0,09 – 20,0 ∙ 10–3 ∙ 0,12 = 0,75 ∙ 10–3 моль;
n1(HCN) = 20,0 ∙ 10–3 ∙ 0,12 = 2,4 ∙ 10–3 моль.
Поскольку сильная кислота HCl подавляет диссоциацию слабой кислоты HCN, то рН определяется только ее концентрацией.
Объем раствора (V) составит 20,0 + 35,0 = 55,0 мл.
Рассчитаем концентрацию HCl в растворе:
С(HCl) = 0,75 ∙ 10–3/ 55,0 ∙ 10–3 = 0,014 моль/л.
Исходя из состава раствора, выбираем формулу (1) для расчета рН сильных кислот:
pH = – lg[С(HCl)] = – lg(0,014) = 1,87.
Пример 9. Вычислить рН раствора, полученного при сливании 10,0 мл 0,1 моль/л раствора Na2HAsO4 и 16,0 мл 0,1 моль/л раствора HCl.
Решение. После сливания растворов могут протекать следующие реакции:
Na2HAsO4 + HCl = NaH2AsO4 + NaCl (10)
NaH2AsO4 + HCl = H3AsO4 + NaCl (11)
Рассчитаем количества вещества в исходных растворах:
n(Na2HAsO4) = 10,0 ∙ 10–3 ∙ 0,1 = 1,0 ∙ 10–3 моль.
n(HCl) = 16,0 ∙ 10–3 ∙ 0,1 = 1,6 ∙ 10–3 моль.
Так как Na2HAsO4 взят в недостатке, то всё количество его прореагирует с HCl согласно уравнению (10), и после протекания реакции (10) в растворе останется 1,0 ∙ 10–3 моля NaH2AsO4 и (1,6 – 1,0) ∙ 10–3 =
= 0,6 ∙ 10– 3 моль HCl. Аналогично после реакции (11) в растворе будут находиться H3AsO4 и NaH2AsO4 в следующих количествах:
n(NaH2AsO4) = 1,0 ∙ 10–3 – 0,6 ∙ 10–3 = 0,4 ∙ 10–3 моль;
n(H3AsO4) = 0,6 ∙ 10–3 моль.
Объем раствора после смешения составит 10 + 16 = 26 мл, или 26 ∙ 10–3 л. Рассчитаем концентрации компонентов в растворе:
С(NaH2AsO4) = 0,4 ∙ 10–3/ 26 ∙ 10–3 = 0,015 моль/л;
С(H3AsO4) = 0,6 ∙ 10–3/ 26 ∙ 10–3 = 0,023 моль/л.
Исходя из состава раствора, выбираем формулу (7) для расчета рН буферных растворов:
pH = 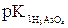 – lg(С(H3AsO4) / С(NaH2AsO4)) =
– lg(С(H3AsO4) / С(NaH2AsO4)) =
= 2,22 – lg(0,023/0,015) = 2,03.
Решение задач № 95, 96 и 98–100 проводится непосредственно по уравнениям для расчета рН.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 842; Нарушение авторских прав?; Мы поможем в написании вашей работы!