
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет равновесных концентраций ионов
|
|
|
|
РЕАКЦИИ КОМПЛЕКСООБРАЗОВАНИЯ
Реакцию комплексообразования можно представить в следующем виде:

Константа равновесия этого процесса называется константой устойчивости комплексного соединения и обозначается  .
.
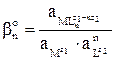 .
.
Общим в решении задач № 143–150 и №166–175 является расчет равновесной концентрации ионов на основании равновесия комплексообразования с использованием константы устойчивости. После этого в задачах № 143–150 рассчитывается окислительно-восстановительный потенциал.
Пример 13 поможет Вам при решении задач №143–150 и 166–175.
Пример 13. Вычислить окислительно-восстановительный потенциал пары Cd2+/Cd в растворе, содержащем 0,1 моль/л CdCl2 и 3 моль/л KCN.
Решение. Окислительно-восстановительный потенциал пары Cd2+/Cd рассчитывается по уравнению Нернста:
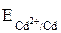 =
=  + 0,059/2 ∙ lg [Cd2+]
+ 0,059/2 ∙ lg [Cd2+]
В растворе протекает реакция комплексообразования:
Cd2+ + 4CN– = 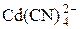 ,
,
поэтому равновесная концентрация ионов Cd2+ определяется процессом комплексообразования, протекающим в присутствии избытка CN – . Равновесие образования комплекса 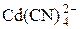 характеризуется константой устойчивости:
характеризуется константой устойчивости:
 =
= 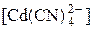 /([Cd2+] ∙ [CN–]4) = 1,29 ∙ 1017.
/([Cd2+] ∙ [CN–]4) = 1,29 ∙ 1017.
При значительном избытке лиганда и достаточно большой константе устойчивости можно принять, что  =
=  = = 0,1 моль/л, [CN–] =
= = 0,1 моль/л, [CN–] = 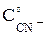 – 4 ∙
– 4 ∙  = 3 – 4 ∙ 0,1 = 2,6 моль/л.
= 3 – 4 ∙ 0,1 = 2,6 моль/л.
Равновесную концентрацию ионов Cd2+ рассчитаем по формуле
[Cd2+] =  / [
/ [ 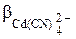 ∙ (
∙ (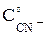 – 4 ∙
– 4 ∙  )] =
)] =
= 0,1 / 1,29 ∙ 1017 ∙ (2,6)4 = 1,69 ∙ 10–20 моль/л.
Найдем по справочнику  = – 0,402 В.
= – 0,402 В.
Отсюда
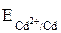 = – 0,402 + 0,059/2 ∙ lg 1,69 ∙ 10–20 = – 0,985 В.
= – 0,402 + 0,059/2 ∙ lg 1,69 ∙ 10–20 = – 0,985 В.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1691; Нарушение авторских прав?; Мы поможем в написании вашей работы!