
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Средняя арифметическая скорость
|
|
|
|
 (2.19)
(2.19)
Относительная скорость применяется для расчета числа молекул, движущихся со скоростями в интервале от v до v + dv:
u = v/vв. (2.20)
Закон распределения молекул идеального газа по скоростям в стационарном состоянии (распределение Максвелла):
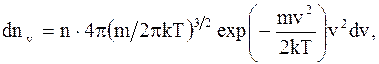 (2.21)
(2.21)
где dnv - среднее число молекул в единице объема со скоростями в интервале от v до v + dv;
n - число молекул в единице объема.
Функция распределения (доля молекул от их общего числа отнесена к некоторому интервалу скоростей):
 или
или  , (2.22)
, (2.22)
где dnv/ndv - функция распределения.
Свободные пробеги молекул - прямолинейные участки траектории, проходимые молекулой между двумя последовательными соударениями.
Средняя длина свободного пробега молекулы – среднее расстояние, проходимое молекулой между двумя соударениями:
 (2.23)
(2.23)
где Z - число соударений;
<v> - средняя скорость молекулы;
k - постоянная Больцмана;
<d> - диаметр молекулы;
p - давление;
T - абсолютная температура.
Среднее число соударений - число соударений молекул <Z>, численно равное отношению средней скорости движения молекул <v> к средней длине свободного пробега:
 ,
, 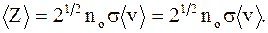 (2.24)
(2.24)
Эффективный диаметр молекулы d - минимальное расстояние, на которое сближаются при столкновении центры 2-х молекул.
Эффективное сечение - величина равная
s = pd2. (2.25)
Барометрическая формула показывает, что давление убывает с высотой тем быстрее, чем тяжелее газ и чем ниже его температура:
 (2.26)
(2.26)
Закон распределения молекул газа по высоте в поле сил тяготения (распределение Больцмана):
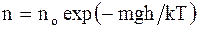 ,
,  , (2.27)
, (2.27)
где no - число молекул в единице объема в том месте, где потенциальная энергия молекул равна нулю;
n - число молекул в единице объема в тех точках пространства, где потенциальная энергия молекул равна Wp.
Распределение Максвелла-Больцмана - благодаря этому распределению можно определить долю молекул идеального газа, имеющих скорости в интервале от v до v + dv и обладающих потенциалом c = gh во внешнем силовом поле:
 , (2.28)
, (2.28)
где vв - наиболее вероятная скорость, значению которой соответствует максимум кривой Максвелла.
Зависимость плотности газа от высоты:
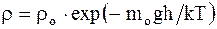 ;
; 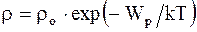 , (2.29)
, (2.29)
где mo - масса одной молекулы.
2.3. Основные положения и законы термодинамики
Первое начало термодинамики - закон сохранения и превращения энергии, которым сопровождаются термодинамические процессы – количество тепла, подводимого к системе, идет на изменение ее внутренней энергии и работу, производимую системой против внешних сил:
 , (2.30)
, (2.30)
где dU - изменение внутренней энергии системы;
dQ - элементарное количество тепла, подводимого к системе;
dA - элементарная работа, совершаемая системой.
Изотермический процесс - процесс, протекающий при постоянной температуре (T = const). При изотермическом процессе все подводимое к системе тепло идет на совершение этой системой работы  , при этом dU = CvdT = 0,
, при этом dU = CvdT = 0,
а U = = const.
Работа, совершаемая произвольной массой m идеального газа при изотермическом процессе:
 . (2.31)
. (2.31)
Изобарический процесс – процесс, протекающий при постоянном давлении (p = const). При этом подводимое к системе тепло идет как на изменение ее внутренней энергии, так и на совершение этой системой работы:
 . (2.32)
. (2.32)
Работа, совершаемая произвольной массой m идеального газа при изобарическом процессе:
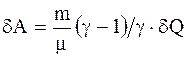 . (2.33)
. (2.33)
Изменение внутренней энергии произвольной массы m идеального газа при изобарическом процессе:
 . (2.34)
. (2.34)
Изохорический процесс – процесс, протекающий при постоянном объеме (V = const). При этом все подводимое к системе тепло идет на изменение ее внутренней энергии:
 ,
,  (2.35)
(2.35)
Адиабатический процесс - процесс, протекающий без теплообмена или почти без теплообмена с окружающей средой. При этом работа может совершаться системой только за счет убыли ее внутренней энергии:
 ,
, 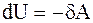 . (2.36)
. (2.36)
Уравнения адиабатического процесса (уравнения Пуассона):
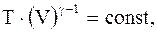
 ;
; 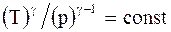 . (2.37)
. (2.37)
Работа, совершаемая произвольной массой m идеального газа при адиабатическом расширении:
 . (2.38)
. (2.38)
Политропический процесс - такой процесс, при котором p и V связаны соотношением:
 , (2.39)
, (2.39)
где n - показатель политропы, принимающий любые значения от - ¥ до + ¥. В частности для изобарического процесса n = 0, изотермического - n = 1, адиабатического - n = g, изохорического - n = ¥.
Работа, совершаемая произвольной массой m идеального газа при политропическом процессе:
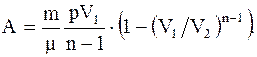 (2.40)
(2.40)
Работа, совершаемая идеальным газом при круговом процессе, равна разности работ при расширении А1 и при сжатии А2 газа и эквивалентна разности количеств тепла, подводимого к системе при расширении Q1 и отводимого от нее при сжатии Q2:
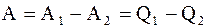 . (2.41)
. (2.41)
Коэффициент полезного действия кругового процесса (цикла) -физическая величина, равная отношению работы цикла к работе, которую можно было бы совершить при превращении в нее всего количества тепла, подведенного к системе:
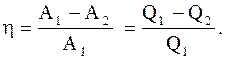 (2.42)
(2.42)
Цикл Карно - цикл, состоящий из двух изотермических и двух адиабатических процессов.
Работа, совершаемая произвольной массой m идеального газа в цикле Карно, - разность между работой, совершенной системой при расширении, и работой, совершенной над системой при ее сжатии:
 . (2.43)
. (2.43)
Коэффициент полезного действия цикла Карно h не зависит от природы вещества, а зависит лишь от температур, при которых теплота сообщается системе и отбирается от нее:
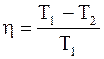 . (2.44)
. (2.44)
Коэффициент полезного действия холодильной машины (холодильника):
 (2.45)
(2.45)
Цикл Отто состоит из двух адиабат и двух изохор.
Цикл Дизеля состоит из двух адиабат, изохоры и изобары.
Энтропия - физическая величина, элементарное изменение которой при переходе системы из одного состояния в другое равно полученному или отданному количеству теплоты, деленному на температуру, при которой произошел этот процесс:
 . (2.46)
. (2.46)
Связь энтропии системы с термодинамической вероятностью (соотношение Больцмана):
S = k×ln w, (2.47)
где k - постоянная Больцмана.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 945; Нарушение авторских прав?; Мы поможем в написании вашей работы!