
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение энтропии системы при переходе из одного состояния в другое
|
|
|
|
 . (2.48)
. (2.48)
Изменение энтропии системы при переходе из одного состояния в другое:
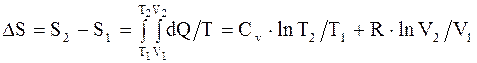 . (2.49)
. (2.49)
Изменение энтропии системы при изотермическом процессе:
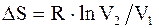 . (2.50)
. (2.50)
Изменение энтропии системы при изобарическом процессе:
 . (2.51)
. (2.51)
Изменение энтропии системы при изохорическом процессе:
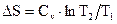 . (2.52)
. (2.52)
Изменение энтропии системы при адиабатическом процессе:
DS = 0, 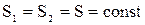 . (2.53)
. (2.53)
Изменение энтропии системы, совершающей цикл Карно:
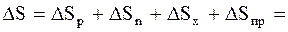
 , (2.54)
, (2.54)
где DSр - изменение энтропии рабочего тела;
DSн, DSх - изменение энтропии нагревателя и холодильника;
DSпр - изменение энтропии "потребителя работы".
В случае совершения системой обратимого цикла Карно энтропия замкнутой системы не изменяется:
DSобр = 0 или Sобр=const. (2.55)
В случае совершения системой необратимого цикла Карно энтропия замкнутой системы возрастает:
DS > 0; 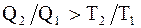 ;
; 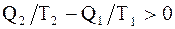 . (2.56)
. (2.56)
Для произвольных процессов, происходящих в замкнутой системе, энтропия системы для любых происходящих в ней процессов не может убывать:
DS ³ 0 или  , (2.57)
, (2.57)
где знак равенства справедлив для обратимых процессов, а знак неравенства - для необратимых.
Второе начало термодинамики: в изолированной системе возможны только такие процессы, при которых энтропия системы возрастает или невозможен процесс, единственным результатом которого является превращение в работу теплоты, полученной от нагревателя:
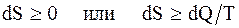 . (2.58)
. (2.58)
Термодинамические потенциалы - определенные функции объема V, давления p, температуры T, энтропии S, числа частиц системы N и других макроскопических параметров x, характеризующих состояние термодинамической системы:
а) внутренняя энергия - энергия системы, зависящая от ее внутреннего состояния. Она является однозначной функцией независимых переменных, определяющих это состояние, например температуры T и объема V (или давления p):
U = U(S,V,N,x). (2.59)
Изменение внутренней энергии системы DU определяется лишь ее значениями в начальном и конечном состояниях:
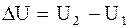 . (2.60)
. (2.60)
б) энтальпия (теплосодержание) характеризует состояние макроскопической системы в термодинамическом равновесии при выборе в качестве основных независимых переменных энтропии S и давления p:
H = H(S,p,N,x). (2.61)
Энтальпия системы равна сумме энтальпий составляющих ее частей.
Связь энтальпии с внутренней энергией U системы:
 , (2.62)
, (2.62)
где V - объем системы.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1295; Нарушение авторских прав?; Мы поможем в написании вашей работы!