
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окисление углерода
|
|
|
|
Основные реакции сталеплавильного процесса
Распределение компонентов между металлом и шлаком
Жидкий металл и шлак в большинстве случаевявляются двумя несмешивающимися жидкостями.
При внесении в систему металл — шлак примеси, она распределяется между этими фазами, процесс распределения характеризуется уравнением
[П] = (П).
В равновесных условиях отношение содержания примеси, распределенной между металлом и шлаком, будет величиной постоянной при данной температуре:
L = (П) / [П].
Это отношение L называется коэффициентом распределения.
Например,
F L = (О) / [О] = 420, при температуре 1600 оС.
F L = (P2O5) / [P] = 50-300, если первоначальное содержание фосфора не выше 0,15%.
F L = (P2O5) / [P] = 400-1000, если первоначальное содержание фосфора 0,3-0,45%.
Переход примеси из одной фазы в другую будет определяться соотношением химических потенциалов
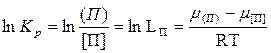 ,
,
где μ[ П ] и μ(П) - соответственно химические потенциалы металла и шлака.
Если химический потенциал примеси в шлаке окажется больше чем химический потенциал примеси в металле, т. е. при соотношении μ(П) > μ[П] примесь будет переходить из шлака в металл до тех пор, пока не установится равенство μ(П) = μ[П]. При соотношении μ(П) < μ[П] примесь будет переходить из, металла в шлак.
Обозначения: [Si] – элемент металла;
{CO} – элемент газа;
(FeO) – элемент шлака.
В чугуне содержится до 4,5% С, в стали содержание углерода должно быть 1,7−2%, поэтому процессы выплавки стали из чугуна всегда сопровождаются реакцией окисления углерода, которую часто называют основной реакцией этих процессов, или процессом обезуглероживания.
Процесс обезуглероживания состоит из трех основных этапов:
а) подвода к месту реакции реагентов – углерода и кислорода;
б) практически мгновенной реакции окисления углерода в основном до оксида углерода [С] +[О] = {СО} или [С] +2[О] = {СО2};
в) выделения продуктов реакции – пузырьков СО (или смеси {СО + СО2}) в газовую фазу.
СО в жидкой стали практически не растворяется, поэтому он непрерывно покидает реакционную зону, процесс идет в сторону уменьшения содержания углерода. Причем, чем выше температура процесса, тем быстрее идет окисление углерода.
Следует отметить, что окисление растворенного в металле углерода осуществляется по трем направлениям:
1) окисление углерода, растворенного в металле, кислородом, также растворенном в металле:
[C] + [O] = {CO};
2) при окислении оксидами железа шлака:
[C] + (FeO) = [Fе]+{СО} с поглощением тепла;
3) при окислении непосредственно кислородом:
[С] + 1/2O2 = {СО} с выделением тепла.
Следует помнить, что при окислении углерода газообразным кислородом выделяется большое количество тепла, при окислении же оксидами железа шлака тепло поглощается.
Пренебрежение этими закономерностями может привести к серьезным авариям.
Например, иногда в конвертер для ускорения обезуглероживания загружают в качестве окислителей слишком большое количество железной руды, окалины и т.п. Температура ванны при этом снижается, поскольку тепло расходуется; во-первых, на нагрев самих добавок, во-вторых, начавшаяся реакция [С] + (FеО) идет с поглощением тепла. В результате кипение ванны прекращается или резко замедляется. В этот период реакция [С] + [О] протекает "вяло", поэтому содержание кислорода в ванне резко возрастает. В дальнейшем по мере повышения температуры ванны (ванна "кипит") реакция [С] +[О] = {СО} интенсифицируется. С повышением температуры интенсифицируется также протекание реакции [С]+ (FеО) = {СО} + [Fе]. Если в ванне оказывается чрезмерно большое количество кислорода, эти реакции приобретают взрывной характер (в короткий период времени в виде пузырьков выделяется значительное количество СО), что приводит к выбросам из конвертера жидкого металла и шлака.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 601; Нарушение авторских прав?; Мы поможем в написании вашей работы!