
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет степени окисления
|
|
|
|
Степень окисления
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Примеры
1. металл + неметалл ® соль
Hg + S ® HgS
2Al + 3I2 ® 2AlI3
2. основной оксид + кислотный оксид ® соль
Li2O + CO2® Li2CO3
CaO + SiO2 ® CaSiO3
3. основание + кислота ® соль
Cu(OH)2 + 2HCl ® CuCl2 + 2H2O
| FeCl3 | + | 3HNO3 | ® | Fe(NO3)3 | + | 3HCl |
| соль | кислота | соль | кислота |
4. металл ® основной оксид
2Ca + O2 ® 2CaO
4Li + O2 ® 2Li2O
5. неметалл ® кислотный оксид
S + O2 ® SO2
4As + 5O2 ® 2As2O5
6. основной оксид ® основание
BaO + H2O ® Ba(OH)2
Li2O + H2O ® 2LiOH
7. кислотный оксид ® кислота
P2O5 + 3H2O ® 2H3PO4
SO3 + H2O ® H2SO4
Степень окисления - это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Например:
N2H4 (гидразин)
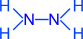
степень окисления азота – -2; валентность азота – 3.
Для вычисления степени окисления элемента следует учитывать следующие положения:
1. Степени окисления атомов в простых веществах равны нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2-1O+2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1).
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Примеры:
V2+5O5-2; Na2+1B4+3O7-2; K+1Cl+7O4-2; N-3H3+1; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1515; Нарушение авторских прав?; Мы поможем в написании вашей работы!