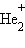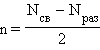КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химических реакций 1 страница
|
|
|
|
Пример
На основании периодической таблицы охарактеризуйте химические элементы с порядковыми номерами 21 и 34.
Для характеристики химического элемента по периодической системе Д.И.Менделеева следует рассмотреть:
1. Положение в периодической таблице (порядковый номер; период, ряд; группа, подгруппа; атомная масса).
2. Строение атома (заряд ядра; состав ядра - количество протонов p11, нейтронов n01 и электронов ē; число энергетических уровней и подуровней; написать формулу электронной конфигурации; квантовые ячейки; по числу и характеру валентных электронов определить тип элемента).
3. Формулы и химический характер соединений (высшего оксида и гидроксида; водородных соединений).
4. Сравнить с соседями (по периоду, по группе).
a) Порядковый номер элемента Z = 21 обозначает: заряд ядра атома элемента (скандия): 6521Sc – +21; число протонов p11: 21Sc – 21 p11; число электронов ē: 21Sc – 21ē; число нейтронов n01 = Ar – Z = 65 – 21 = 44 – 44n10
Формула состава атома
| 6521Sc ( | 21p11; 44n10 | ; 21ē) |
| состав ядра |
Скандий находится в IV периоде; номер периода обозначает число энергетических уровней - 4.
Скандий расположен в побочной подгруппе. Следовательно, его валентные электроны будут находится на 4s- и 3d-подуровнях.
Электронная формула скандия
| 21Sc | 1s2 2s2 2p6 3s2 3p6 | 3d1 4s2 |
| [Ar] |
или в виде сокращенной записи: [Ar] 3d14s2
Электронная формула в виде квантовых ячеек:
| 21Sc [Ar] | 
|
Скандий – d- элемент. Электронное строение атома заканчивается s- электронами, поэтому элемент будет проявлять металлические свойства.
Формула высшего оксида – Sc2O3, гидроксида – Sc(OH)3 обладают слабыми основными свойствами. Соединений с водородом не образует.
b) Порядковый номер 34 имеет селен Se. Элемент находится в IV периоде, значит в атоме имеется 4 энергетических уровня. Он находится в главной подгруппе VI группы; его валентные электроны распределены на 4s и 4p-подуровнях.
Электронная формула селена:
34Se 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4
Внешний уровень в виде квантовых ячеек имеет вид:

|
Атом селена имеет 6 валентных электронов; поэтому высшая валентность равна 6, что соответствует номеру группы.
Селен - p- элемент, поэтому будет проявлять свойства неметалла.
Высший оксид SeO3, его гидроксид H2SeO4 и газообразное водородное соединение H2Se имеют кислотный характер.
Химическая связь window.top.document.title = "3.1. Химическая связь";
Образование из атомов молекул, молекулярных ионов, ионов, кристаллических, аморфных и других веществ сопровождается уменьшением энергии по сравнению с невзаимодействующими атомами. При этом минимальной энергии соответствует определенное расположение атомов друг относительно друга, которому отвечает существенное перераспределение электронной плотности. Силы, удерживающие атомы в новых образованиях, получили обобщенное название «химическая связь». Важнейшие виды химической связи: ионная, ковалентная, металлическая, водородная, межмолекулярная.
Согласно электронной теории валентности, химическая связь возникает за счет перераспределения электронов валентных орбиталей, в результате чего возникает устойчивая электронная конфигурация благородного газа (октет) за счет образования ионов (В. Коссель) или образования общих электронных пар (Г. Льюис).
Химическая связь характеризуется энергией и длиной. Мерой прочности связи служит энергия, затрачиваемая на разрушение связи, или выигрыш в энергии при образовании соединения из отдельных атомов (Eсв). Так, на разрыв связи H–H затрачивается 435 кДж∙моль–1, а на атомизацию метана CH4 – 1648 кДж∙моль–1, в этом случае EC–H = 1648: 4 = 412 кДж. Длина связи (нм) – расстояние между ядрами в том или ином соединении. Обычно длина связи и ее энергия антибатны: чем больше длина связи, тем меньше ее энергия.
Химическая связь обычно изображается черточками, соединяющими взаимодействующие атомы; каждая черта эквивалентна обобщенной паре электронов. В соединениях, содержащих более двух атомов, важной характеристикой является валентный угол, образуемый химическими связями в молекуле и отражающий ее геометрию.

|
| Рисунок 3.1. Сложение дипольных элементов в молекулах NH3 и NF3. |
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность связи может быть выражена через ее дипольный момент μ, равный произведению элементарного заряда на длину диполя *) μ = e ∙ l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
*) Диполь – система из двух равных, но противоположных по знаку зарядов, находящихся на единичном расстоянии друг от друга. Дипольный момент измеряется в кулон-метрах (Кл∙м) или в дебаях (D); 1D = 0,333∙10–29 Кл∙м.
Все эти факторы следует учитывать. Например, для линейной молекулы CO2 μ = 0, но для SO2 μ = 1,79 D вследствие ее углового строения. Дипольные моменты NF3 и NH3 при одинаковой гибридизации атома азота (sp3), примерно одинаковой полярности связей N–F и N–H (ОЭО N = 3; ОЭО F = 4; ОЭО H = 2,1) и сходной геометрии молекул существенно различаются, поскольку дипольный момент неподеленной пары электронов азота при векторном сложении в случае NH3 увеличивает μ молекулы, а в случае NF3 уменьшает его (рис. 3.1).
Типы химических связей window.top.document.title = "3.2. Типы химических связей";
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
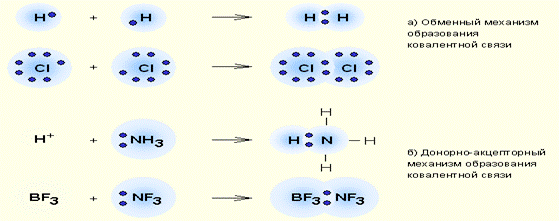
|
| Обменный (а) и донорно-акцепторный (б) механизмы образования ковалентной связи. |
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль–1.
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. (HCl, H2O). Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χA – χB) + 3,5(χA – χB)2, где χA и χB – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь ниже (см. метод валентных связей).
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10–29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
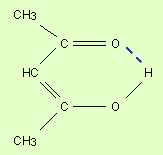
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
|
|
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль–1.
Современные представления о химической связи window.top.document.title = "3.3. Современные представления о химической связи";
Совокупность химически связанных атомов (молекула, кристалл) состоит из атомных ядер и связанных с ними электронов. Положение атомных ядер экспериментально устанавливается довольно точно. Распределение электронной плотности фиксируется менее точно, поскольку в молекуле каждый из валентных электронов может быть обнаружен в окрестности любого ядра. Тем не менее каждому из этих валентных электронов, как и в атоме, соответствует определенный энергетический уровень, называемый молекулярной орбиталью (МО). При построении молекулярных орбиталей используется метод линейной комбинации атомных орбиталей (ЛКАО), обозначаемый аббревиатурой МО – ЛКАО.
Кроме этого подхода рассмотрим метод валентных связей (МВС), основанный на предположении, что химическая связь осуществляется одной или несколькими электронными парами, локализованными между взаимодействующими атомами.
Метод молекулярных орбиталей (ММО) window.top.document.title = "3.3.1. Метод молекулярных орбиталей (ММО)";
Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Например, в молекуле водорода в образовании МО могут участвовать только 1s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1s1 и 1s2 – МО± = C11s1 ± C21s2.

|
Поскольку ядра во взаимодействующих атомах водорода одинаковы, то и вклад атомных орбиталей будет одинаковым, что обеспечивается равенством коэффициентов, с которыми s-орбитали участвуют в линейной комбинации (C1 = C2 = C). Поскольку должно выполняться требование, что сумма квадратов коэффициентов при АО равна 1, то имеем 2C2 = 1, откуда  Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
|
Электронная плотность этих двух состояний пропорциональна |MO±|2. Поскольку в молекуле водорода взаимодействие возможно только по оси молекулы, то каждая из MO± может быть переобозначена как σсв = 1s1 + 1s2 и σ* = 1s1 – 1s2 и названа соответственно связывающей (σсв) и разрыхляющей (σ*) молекулярными орбиталями (рис. 3.7).

|
| Распределение электронной плотности в молекуле H2. |
Из рис. видно, что электронная плотность посередине между ядрами для σсв значительна, а для σ* равна нулю. Отрицательно заряженное электронное облако, сконцентрированное в межъядерном пространстве, притягивает положительно заряженные ядра и соответствует связывающей молекулярной орбитали σсв. А МО с нулевой плотностью в межъядерном пространстве соответствует разрыхляющей орбитали σ*. Состояния σсв и σ* отвечают разным уровням энергии, причем молекулярная орбиталь σсв имеет более низкую энергию по сравнению с исходными АО двух невзаимодействующих атомов водорода 1s1 и 1s2.
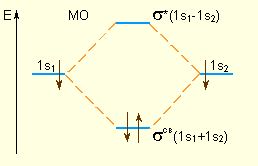
|
| Энергетическая диаграмма атомных и молекулярных уровней водорода. |
Переход двух электронов на МО σсв способствует понижению энергии системы; этот энергетический выигрыш равен энергии связи между атомами в молекуле водорода H–H. Даже удаление одного электрона с МО (σсв)2 c образованием (σсв)1 в молекулярном ионе  оставляет эту систему более устойчивой, чем отдельно существующие атом H и ион H+.
оставляет эту систему более устойчивой, чем отдельно существующие атом H и ион H+.
Рис. ниже иллюстрирует изменение энергии МО σсв и σ* в зависимости от межатомного расстояния r12. При большом расстоянии r12 их энергия будет мало отличаться от энергий АО 1s1 и 1s2. При некотором 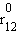 энергия σсв достигнет минимума и будет соответствовать энергии связи Есв молекулы H–H. При дальнейшем сближении ядер энергии σсв и σ* начинают повышаться, поскольку силы отталкивания начинают преобладать над силами притяжения. В молекуле ядра колеблются вблизи равновесного расстояния
энергия σсв достигнет минимума и будет соответствовать энергии связи Есв молекулы H–H. При дальнейшем сближении ядер энергии σсв и σ* начинают повышаться, поскольку силы отталкивания начинают преобладать над силами притяжения. В молекуле ядра колеблются вблизи равновесного расстояния 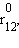 соответствующего минимуму энергии Есв.
соответствующего минимуму энергии Есв.

|
| Энергии МО в H2 в зависимости от межъядерного расстояния. |
Приведенная на рис. энергетическая диаграмма МО справедлива для двухъядерных образований  H2, HHe,
H2, HHe, 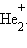 Распределение валентных электронов по МО записывают электронными формулами:
Распределение валентных электронов по МО записывают электронными формулами: 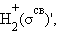
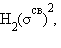

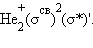
Заселение электронами связывающей МО σсв стабилизирует систему, а заселение разрыхляющих – дестабилизирует ее (табл.).
| ||||||||||||||||||||||||||||||||
| Энергия, длина и порядок связи в молекулах элементов 1 периода. |
Согласно методу МО порядок (кратность) связи n определяется полуразностью числа связывающих Nсв и разрыхляющих Nраз электронов:
|
При нулевой кратности связи, как в случае H2, молекула не образуется.

|
| Модель Сигма- и пи-связи. |
Двухатомные гомоядерные молекулы window.top.document.title = "3.3.2. Двухатомные гомоядерные молекулы";
У элементов второго периода в образовании химических связей принимают участие кроме s- еще и p-орбитали, при этом соблюдаются следующие условия: АО должны иметь близкие энергии, перекрываться в значительной степени, иметь одинаковую симметрию относительно линии связи, число МО должно быть равно числу образующих их АО.
Итак, рассмотрим гомоатомные молекулы второго периода.
Если подуровни 2s- и 2p-состояний достаточно разделены по энергии, комбинации s- и p-АО можно рассматривать раздельно; 2s-орбитали образуют МО σs и σs*. Из рис
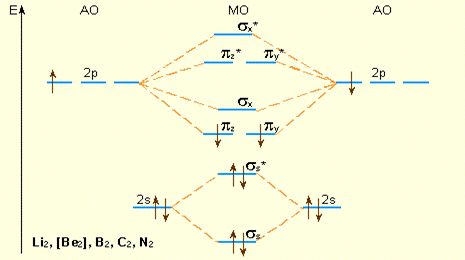
|
| Уровни энергии МО элементов 2 периода (начало периода). Заселение МО указано для B2. |
видно, что возможно образование молекулы Li2(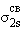 )2, но не Be2, поскольку σ2sсв. и σ2s* заселены одинаково. Одна из 2p-орбиталей, например, 2px-орбиталь, при комбинации с 2px-орбиталью другого атома образует связь σx-типа. Оставшиеся две АО py и pz перпендикулярны линии связи (оси x) и энергетически равноценны. Поэтому они образуют два вырожденных уровня энергии, соответствующих МО
)2, но не Be2, поскольку σ2sсв. и σ2s* заселены одинаково. Одна из 2p-орбиталей, например, 2px-орбиталь, при комбинации с 2px-орбиталью другого атома образует связь σx-типа. Оставшиеся две АО py и pz перпендикулярны линии связи (оси x) и энергетически равноценны. Поэтому они образуют два вырожденных уровня энергии, соответствующих МО 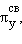
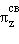 и πy*, πz*. В начале периода s- и p-подуровни близки по энергии, поэтому уровень σx расположен выше πy-, πz-уровней. Поскольку расстояние между s- и p-подуровнями увеличивается в периоде с ростом Z, то схема уровней лучше всего описывает молекулы элементов конца периода, начиная с кислорода.
и πy*, πz*. В начале периода s- и p-подуровни близки по энергии, поэтому уровень σx расположен выше πy-, πz-уровней. Поскольку расстояние между s- и p-подуровнями увеличивается в периоде с ростом Z, то схема уровней лучше всего описывает молекулы элементов конца периода, начиная с кислорода.
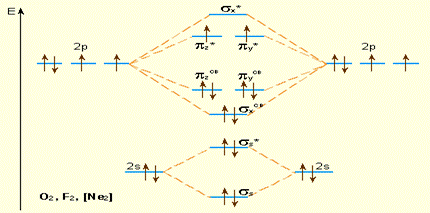
|
| Уровни энергии МО элементов 2 периода (конец периода). Заселение МО указано для О2. |
В табл. ниже приводятся схемы МО гомоядерных молекул элементов второго периода. Как видно из нее, кратность, длина и энергия связи определяются числом связывающих и разрыхляющих электронов.
Если воспользоваться рассмотренными символами, то электронную формулу молекулы кислорода можно записать так: (σs)2(σs*)2(σx)2 (πy, πz)4(πy*, πz*)2.
Анализ табл. позволяет сделать ряд выводов.
1. Удаление электрона со связывающей орбитали уменьшает энергию связи в молекулярном ионе ( и N2), а удаление электрона с разрыхляющей орбитали приводит к увеличению энергии связи в молекулярном ионе в сравнении с молекулой (
и N2), а удаление электрона с разрыхляющей орбитали приводит к увеличению энергии связи в молекулярном ионе в сравнении с молекулой (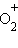 и O2).
и O2).
2. Потенциал ионизации молекулы ( ) больше потенциала ионизации атома (IЭ), если в молекуле верхний заполненный уровень – связывающий. И наоборот,
) больше потенциала ионизации атома (IЭ), если в молекуле верхний заполненный уровень – связывающий. И наоборот,  меньше, чем IЭ, если верхний заполненный уровень – разрыхляющий. Например,
меньше, чем IЭ, если верхний заполненный уровень – разрыхляющий. Например, 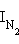 = 15,58 эВ, а IN = 14,53 эВ, но
= 15,58 эВ, а IN = 14,53 эВ, но 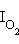 = 12,08 эВ, а IO = 13,62 эВ.
= 12,08 эВ, а IO = 13,62 эВ.
3. Схема МО легко объясняет наличие неспаренных электронов, а следовательно, парамагнетизм таких частиц, как молекулы B2 и O2, и молекулярных ионов  и
и 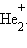
В случае гетероядерных молекул в связывающие орбитали значительный вклад вносят атомы с большой электроотрицательностью, и связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома.

Рисунок
Энергетическая диаграмма МО гетероядерной молекулы АВ, где A имеет меньшую электроотрицательность, чем B.
Величина «b» антибатна ковалентности связи. Cледует отметить, что в общем виде для гетероатомных изоэлектронных молекул можно использовать одни и те же схемы МО. Например, для рассмотрения строения СО, BF, NO+ и CN– можно использовать схему МО для N2, так как у всех этих частиц по 10 валентных электронов.
Однако в отличие от гомоядерных эти молекулы хотя и изоэлектронны, но образованы атомами с неодинаковыми зарядами атомов Z. Например, в молекуле СО АО кислорода лежат ниже АО углерода (это различие отражается на величинах потенциалов ионизации атомов: I1 углерода – 11,09 эВ, I1 кислорода – 13,62 эВ). Схема МО молекул СО, BF и молекулярных ионов NO+, CN– несколько трансформирована по сравнению с N2 в соответствии с требованиями построения диаграмм МО гетероядерных молекул.
При сохранении кратности связи энергия связи СО равна 1070 кДж∙моль–1 против 842 кДж∙моль–1 в N2. Это увеличение вызвано дополнительным вкладом ионной составляющей из-за разности электроотрицательностей атомов углерода и кислорода. Адекватное экспериментальным данным строение монооксида углерода соответствует формуле C–≡O+. Такое необычное распределение зарядов обусловлено переходом лишней по сравнению с углеродом (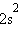
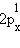

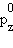 ) электроннной пары O(
) электроннной пары O(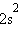
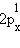

 ) на молекулярные орбитали СО и хорошо согласуется с экспериментальной величиной дипольного момента СО μ = –0,027∙10–29 Кл∙м (–0,08 D). Отрицательный знак означает направление дипольного момента от кислорода к углероду.
) на молекулярные орбитали СО и хорошо согласуется с экспериментальной величиной дипольного момента СО μ = –0,027∙10–29 Кл∙м (–0,08 D). Отрицательный знак означает направление дипольного момента от кислорода к углероду.

|
| Энергетическая диаграмма МО молекулы СО. |
Свойства двухатомных молекул p-элементов II периода window.top.document.title = "3.3.3. Свойства двухатомных молекул p-элементов II периода";
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица 3.2. Схемы МО, электронных конфигураций и молекулярные параметры двухатомных гомоядерных молекул p-элементов II периода. |
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 619; Нарушение авторских прав?; Мы поможем в написании вашей работы!