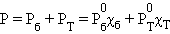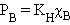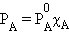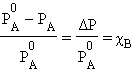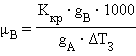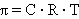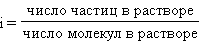КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы неэлектролитов. window.top.document.title = "6.3
|
|
|
|
window.top.document.title = "6.3. Растворы неэлектролитов";
По термодинамическому признаку растворы делятся на идеальные и реальные. Для идеальных растворов предполагается, что между компонентами раствора любыми взаимодействиями можно пренебречь. Следовательно, любое свойство растворяемых веществ при их смешении не должно меняться. Например, при смешении близких по свойствам бензола и толуола давление пара P над раствором в соответствии с законом Дальтона будет аддитивной величиной
|
Здесь 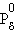 и χδ,
и χδ,  и χT – соответственно давление и мольные доли бензола и толуола.
и χT – соответственно давление и мольные доли бензола и толуола.

|
| Зависимость давления пара над смесью бензол–толуол от мольной доли. |
Если раствор сохраняет свойства идеальности при любых концентрациях, его называют совершенным (растворы изотопов). Часто раствор приобретает эти качества только при достаточно большом разведении, это – «бесконечно разбавленный» раствор при χ→0. Во всех прочих случаях раствор считается реальным.
Взаимодействие между компонентами раствора, выражаемое через энтальпию сольвации ΔHсольв, служит в определенных пределах мерой идеальности раствора. Д. И. Менделеев показал, что взаимодействие между компонентами раствора может рассматриваться как химический процесс образования соединений переменного состава – сольватов. Этот подход лежит в основе химической или сольватной теории растворов. Если при кристаллизации твердая фаза содержит молекулы растворителя, то ее называют кристаллосольватом.
Закон Генри window.top.document.title = "6.3.1. Закон Генри";
Если растворенное вещество характеризуется большой упругостью пара по сравнению с упругостью пара растворителя (PB >> PA) и при этом оба компонента раствора химически инертны, то растворение такого газообразного вещества в жидкости подчиняется закону Генри: при постоянной температуре давление летучего (газообразного) компонента PB прямо пропорционально его мольной доле χB:
|
KH – константа Генри.
В табл. приведены константы Генри некоторых газов для воды.
| ||||||||||||||
| Константы Генри для воды при 298 K. |
Из уравнения следует, что KH определяется выбором единиц давления и концентрации
Законы Рауля window.top.document.title = "6.3.2. Законы Рауля";
Если упругость пара растворенного вещества очень мала PB << PA, то его парциальным давлением можно пренебречь (нелетучий компонент), и тогда упругость пара над раствором будет зависеть только от парциального давления растворителя:
|
Это первый закон Рауля – парциальное давление над раствором прямо пропорционально мольной доле растворенного вещества. После подстановки χA = 1 – χB и несложных преобразований
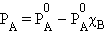
|
получаем
|
Относительное понижение упругости пара над раствором равно мольной доле растворенного вещества. Это закон Рауля для нелетучего растворенного компонента. Из этого закона можно вывести два следствия, которые в объединенном виде формируются как второй закон Рауля.
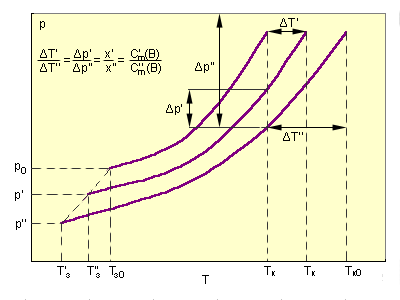
|
| Зависимость повышения температуры кипения ΔTкип и понижения температуры замерзания ΔTзам раствора от концентрации растворенного вещества. |
На рис. приведены зависимости P(T) чистого растворителя и двух его растворов P'(T) и P''(T).
Выразим мольную долю χi через моляльную концентрацию 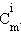 Для двухкомпонентного раствора χB = 1 – χA. При Cm << 1 получим
Для двухкомпонентного раствора χB = 1 – χA. При Cm << 1 получим
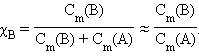
|
Из подобия треугольников следует
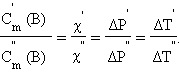
|
По определению, при 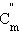 (B) = 1 моль∙кг–1 повышение температуры
(B) = 1 моль∙кг–1 повышение температуры 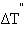 равно Kэб – эбулиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
равно Kэб – эбулиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
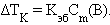
|
Проведя аналогичное исследование, касающееся понижения температуры замерзания раствора, получим
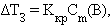
|
где Kкр – криоскопическая константа.
Второй закон Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:
|
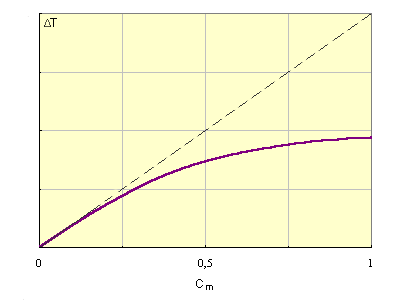
Kэб и Kкр являются экстраполяционными величинами от малых концентраций растворенного вещества, где выполняется этот закон, на Cm(B) = 1, где этот закон уже не действует. В табл. приведены Kкр и Kэф для воды и бензола.
|
| Иллюстрация справедливости второго закона Рауля для разбавленных растворов и экстраполяционной природы Kкр и Kэб. |
| |||||||||
| Криоскопические и эбулиоскопические константы для воды и бензола (град∙моль–1∙кг). |
Второй закон Рауля дает легко осуществимую экспериментально возможность определения молекулярных масс некоторых молекулярных соединений, неспособных к диссоциации в данном растворителе. Действительно, моляльная концентрация растворенного вещества может быть представлена в виде соотношения Cm = gB ∙ 1000 / μB ∙ gA, где gA – вес растворителя, gB – вес растворенного вещества, μB – его молярная масса. Тогда из ΔT = Kкр ∙ m получим молярную массу растворенного вещества:
|
Осмос window.top.document.title = "6.3.3. Осмос";
Если система, разделенная мембраной, представляет собой растворы, в которых через мембрану способны проходить только молекулы растворителя, то свойства ее будут определяться разностью мольных долей (концентраций) растворителя по обе стороны мембраны.
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. Явление осмоса чрезвычайно разнообразно и во многом определяется природой мембраны и компонентов раствора.
Представим, что сосуд с двумя горлами для залива раствора разделен мембраной M (рис.). В каждую часть сосуда зальем растворы, отличающиеся только концентрацией. Поскольку мольные доли растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведет к переходу части растворителя в ту часть сосуда, где концентрация растворенного вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнется в сторону с меньшей концентрацией растворенного вещества (рис. а).
Если мембрана жесткая, то в отсеке с большей концентрацией количество растворителя будет возрастать до тех пор, пока гидростатическое давление h (рис. б) не станет равным осмотическому давлению и не прекратит осмос.

|
| Схема разности осмотических давлений при χ1 < χ2 при эластичной (а) и жесткой (б) мембранах. |
Осмотическое давление π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
Эту зависимость Вант-Гофф уподобил поведению идеального газа:
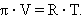
|
По Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде
|
Так как объем одного моля газообразного вещества при нормальных условиях равен 22,4 литра, то осмотическое давление раствора, содержащего 1 моль вещества, равно 22,4 атм.
Измерение осмотического давления раствора используется для определения молекулярных масс даже разбавленных растворов, что позволяет оценивать молекулярные массы растворимых высокомолекулярных соединений, в частности, биополимеров. Заменив C(B) в формуле Вант-Гоффа соотношением (m(B) ∙ 1000 / μ(B) ∙ V), получим уравнение, позволяющее вычислять молекулярные массы растворенных веществ:
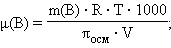
|
m(B) – масса растворенного вещества, V – объем раствора.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворенного вещества, изотоничность является следствием одинакового числа частиц в растворе.
Поскольку при растворении реальное число частиц может отличаться от числа растворенных молекул, Вант-Гофф ввел понятие изотонического коэффициента i. По определению это отношение числа всех частиц к числу растворенных молекул:
|
В бензольном растворе уксусной кислоты i < 1, ибо в этом растворе число частиц меньше числа молекул, в результате реакции ассоциации в соответствие с уравнением
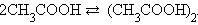
|
Если же в растворе преобладает не ассоциативный, а диссоциативный или ионизационный механизмы взаимодействия, то i > 1. Так, в водном растворе уксусная кислота диссоциирует CH3COOH = CH3COO– + H+, и число частиц становится больше числа молекул.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
ЭЛЕКТРОЛИТЫ И НЕЭЛЕКТРОЛИТЫ
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 441; Нарушение авторских прав?; Мы поможем в написании вашей работы!