
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронное строение атомов
|
|
|
|
Радиоактивность
Радиоактивность - самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер (например, α- частиц).
Радиоактивность, проявляемая природными изотопами элементов, называется естественной радиоактивностью.
Самопроизвольный распад ядер описывается уравнением: mt = m0 • (1/2)t / T1/2 где mt и m0 - массы изотопа в момент времени t и в начальный момент времени; Т1/2 - период полураспада, который является постоянным для данного изотопа. За время Т1/2 распадается половина всех ядер данного изотопа.
Основные виды радиоактивного распада.
a - распад. Сопровождается потоком положительно заряженных ядер атома гелия 42Не (a - частиц) со скоростью 20000 км/с. При этом заряд Z исходного ядра уменьшается на 2 единицы (в единицах элементарного заряда), а массовое число А - на 4 единицы (в атомных единицах массы).
Z' = Z – 2
A' = A – 4
т.е. образуется атом элемента, смещенного по периодической системе на две клетки влево, от исходного радиоактивного элемента, а его массовое число на 4 единицы меньше исходного.
| 226 82 | Ra ® | 222 80 | Rh + | 4 2 | He |
b - распад. Излучение ядром атома потока электронов со скоростью 100'000 - 300'000 км/с. (Электрон образуется при распаде нейтрона ядра. Нейтрон может распадаться на протон и электрон.) При - распаде массовое число изотопа не изменяется, поскольку общее число протонов и нейтронов сохраняется, а заряд ядра увеличивается на 1. (Химический элемент смещается в периодической системе на одну клетку вправо, а его массовое число не изменяется)
| 234 90 | Th ® | 234 91 | Po + | 0 -1 | e |
g- распад. Возбужденное ядро испускает электромагнитное излучение с очень малой длиной волны и высокой частотой, обладающее большой проникающей способностью, при этом энергия ядра уменьшается, массовое число и заряд остаются неизменными. (Химический элемент не смещается в периодической системе, его массовое число не изменяется и лишь ядро его атома переходит из возбужденного состояния в менее возбужденное).
Ядерные реакции - превращения ядер, происходящие при их столкновении друг с другом или с элементарными частицами. Первая искусственная ядерная реакция была осуществлена Э.Резерфордом (1919 г.) при бомбардировке ядер азота a- частицами:
| 14 7 | N + | 4 2 | He ® | 17 8 | O + | 1 1 | H |
С помощью ядерных реакций были получены изотопы многих химических элементов и ядра всех химических элементов с порядковыми номерами от 93 до 110.
Корпускулярно-волновые свойства частиц window.top.document.title = "2.1. Корпускулярно-волновые свойства частиц";
В 20-х годах XX столетия было установлено, что любая частица имеет корпускулярно-волновую природу. Согласно теории Л. де Бройля (1924 г.), каждой частице с импульсом 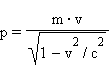 соответствует волновой процесс с длиной волны λ, т.е. λ = h / p. Чем меньше масса частицы, тем больше длина волны. Для элементарных частиц В. Гейзенберг сформулировал принцип неопределенности, согласно которому невозможно одновременно определить положение частицы в пространстве и ее импульс. Следовательно, нельзя рассчитать траекторию движения электрона в поле ядра, можно лишь оценить вероятность его нахождения в атоме с помощью волновой функции ψ, которая заменяет классическое понятие траектории. Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ2 определяет пространственное распределение электрона в атоме. В наиболее простом варианте волновая функция зависит от трех пространственных координат и дает возможность определить вероятность нахождения электрона в атомном пространстве или его орбиталь. Таким образом, атомная орбиталь (АО) – область атомного пространства, в котором вероятность нахождения электрона наибольшая. Волновые функции получаются при решении основополагающего соотношения волновой механики – уравнения Шредингера. (Точное решение получается для атома водорода или водородоподобных ионов, для многоэлектронных систем используются различные приближения). Поверхность, ограничивающая 90–95 % вероятности нахождения электрона или электронной плотности, называют граничной. Атомная орбиталь и плотность электронного облака имеют одинаковую граничную поверхность (форму) и одинаковую пространственную ориентацию. Атомные орбитали электрона, их энергия и направление в пространстве зависят от четырех параметров – квантовых чисел.
соответствует волновой процесс с длиной волны λ, т.е. λ = h / p. Чем меньше масса частицы, тем больше длина волны. Для элементарных частиц В. Гейзенберг сформулировал принцип неопределенности, согласно которому невозможно одновременно определить положение частицы в пространстве и ее импульс. Следовательно, нельзя рассчитать траекторию движения электрона в поле ядра, можно лишь оценить вероятность его нахождения в атоме с помощью волновой функции ψ, которая заменяет классическое понятие траектории. Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ2 определяет пространственное распределение электрона в атоме. В наиболее простом варианте волновая функция зависит от трех пространственных координат и дает возможность определить вероятность нахождения электрона в атомном пространстве или его орбиталь. Таким образом, атомная орбиталь (АО) – область атомного пространства, в котором вероятность нахождения электрона наибольшая. Волновые функции получаются при решении основополагающего соотношения волновой механики – уравнения Шредингера. (Точное решение получается для атома водорода или водородоподобных ионов, для многоэлектронных систем используются различные приближения). Поверхность, ограничивающая 90–95 % вероятности нахождения электрона или электронной плотности, называют граничной. Атомная орбиталь и плотность электронного облака имеют одинаковую граничную поверхность (форму) и одинаковую пространственную ориентацию. Атомные орбитали электрона, их энергия и направление в пространстве зависят от четырех параметров – квантовых чисел.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 401; Нарушение авторских прав?; Мы поможем в написании вашей работы!