
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Pb O2 H2 SO4 + H2 O
|
|
|
|
↓ ↓ ↓
H+ ← 2O2– 2H+ SO42-
↓
H2 O
Pb SO4
Рис. 2.1. Процесс разряда аккумулятора
Часть серной кислоты в электролите диссоциирована на положительные ионы водорода Н+ и отрицательные ионы кислотного остатка SO42-. Губчатый свинец при разряде аккумулятора выделяет в электролит положительные ионы двухвалентного свинца РЬ2+. Избыточные электроны отрицательного электрода по внешнему участку замкнутой электрической цепи перемещаются к положитепьному электроду, где восстанавливают четырехвалентные ионы свинца РЬ4+ до двухвалентного свинца РЬ2+. Положительные ионы свинца РЬ2+ соединяются с отрицательными ионами кислотного остатка SO42-, образуя на обоих электродах сернокислый свинец PbSО4 (сульфат свинца).
При подключении аккумулятора к зарядному устройству электроны движутся к отрицательному электроду, нейтрализуя двухвалентные ионы свинца РЬ2+. На электроде выделяется губчатый свинец РЬ. Отдавая под влиянием напряжения внешнего источника тока по два электрона, двухвалентные ионы свинца РЬ2+ у положительного электрода окисляются в четырехвалентные ионы РЬ4+. Через промежуточные реакции ионы РЬ4+. соединяются с двумя ионами кислорода и образуют двуокись свинца PbO2,
Химические реакции в свинцовом аккумуляторе описываются уравнением:
разряд

 РЬО2 + 2H2SО4 + РЬ2PbSО4 + 2Н2О.
РЬО2 + 2H2SО4 + РЬ2PbSО4 + 2Н2О.
заряд
Содержание в электролите серной кислоты и плотность электролита уменьшаются при разряде и увеличиваются при заряде. По плотности электролита судят о степени разряженности свинцового аккумулятора:
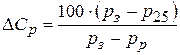 ,
,
где 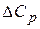 – степень разряженности аккумулятора, %;
– степень разряженности аккумулятора, %;  – плотность электролита соответственно полностью заряженного и полностью разряженного аккумулятора при температуре 25°С, г/см2;
– плотность электролита соответственно полностью заряженного и полностью разряженного аккумулятора при температуре 25°С, г/см2;  – измеренная плотность электролита, приведенная к температуре 25°С, г/см3.
– измеренная плотность электролита, приведенная к температуре 25°С, г/см3.
Расход кислоты у положительных электродов больше, чем у отрицательных. Если учитывать количество воды, образующейся у положительных электродов, то количество кислоты, необходимое для них в течение разряда, в 1,6 раза больше, чем для отрицательных. При разряде происходит незначительное увеличение объема электролита, а при заряде – уменьшение (около 1 см3 на 1 А·ч). На 1 А·ч электрической емкости расходуется: при разряде – свинца 3,86 г, диоксида свинца 4,44 г, серной кислоты 3,67 г, а при заряде – воды 0,672 г, сульфата свинца 11,6 г.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 792; Нарушение авторских прав?; Мы поможем в написании вашей работы!