
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вторичные источники или электрические аккумуляторы
|
|
|
|
Принцип действия, устройство и конструктивные схемы АКБ
АКБ относится к химическим источникам электроэнергии. Химическим источником электроэнергии (тока) называется устройство, в котором за счет протекания пространственно разделенных окислительно-восстановительных химических реакций их свободная энергия преобразуется в электрическую [4].
По xарактеру работы эти источники делятся на две группы:
• первичные химические источники электроэнергии (тока) или гальванические элементы;
Первичные источники допускают только однократное использование, так как вещества, образующиеся при их разряде не могут быть превращены в исходные активные материалы. Полностью разряженный гальванический элемент, как правило, к дальнейшей работе непригоден − он является необратимым источником энергии.
Вторичные химические источники тока являются обратимыми источниками энергии – после глубокого разряда их работоспособность можно восстановить путем заряда. Для этого через вторичный источник достаточно пропустить, электрический ток в направлении, обратном тому, в котором он протекал при разряде. В процессе заряда образовавшиеся при разряде вещества, превращаются в первоначальные активные материалы. Так происходит многократное превращение свободной энергии химического источника тока в электрическую энергию (разряд аккумулятора) и обратное превращение электрической энергии в свободную энергию химического источника тока (заряд аккумулятора).
Прохождение тока через электрохимические системы связано с происходящими при этом химическими реакциями (превращениями). Поэтому между количеством вещества, вступившего в электрохимическую реакцию и подвергшегося превращениям, и количеством затраченного или высвободившегося при этом электричества существует зависимость, которая была установлена Майклом Фарадеем.
Согласно первому закону Фарадея масса вещества, вступившего в электродную реакцию или получившегося в результате ее протекания (Δm), пропорциональна количеству электричества (q), прошедшего через систему:
 ,
,
где I – сила тока, проходящего через электрохимическую систему; t – время, в течении которого проходит ток; kэ – коэффициент пропорциональности, который называется электрохимическим эквивалентом и характеризует количество вещества, прореагировавшего при прохождении через систему единицы электрического заряда.
Согласно второму закону Фарадея, при равном количестве прошедшего через систему электричества массы прореагировавших веществ относятся между собой как их химические эквиваленты А (А = mА / Z, где mА – атомный вес вещества, Z – заряд иона):
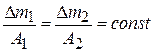 .
.
На практике этот закон не соблюдается, так как параллельно основным электрохимическим реакциям идут побочные. Это учитывает параметр Bm – выход по току:
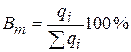 ,
,
где qi – количество электричества, расходуемого на основную реакцию; Σqi – общее количество прошедшего через систему электричества.
Свинцовые аккумуляторы являются вторичными химическими источниками тока, которые могут использоваться многократно. Активные материалы, израсходованные в процессе разряда, восстанавливаются при последующем заряде.
Химический источник тока представляет собой совокупность реагентов (окислителя и восстановителя) и электролита. Восстановитель (отрицательный электрод) электрохимической системы в процессе токообразующей реакции отдает электроны и окисляется, а окислитель (положительный электрод) восстанавливается. Электролитом, как правило, является жидкое химическое соединение, обладающее хорошей ионной и малой электронной проводимостью.
В свинцовом аккумуляторе в токообразующих процессах участвуют двуокись свинца (диоксид свинца) РЬО2 (окислитель) положительного электрода, губчатый свинец РЬ (восстановитель) отрицательного электрода и электролит (водный раствор серной кислоты H2SО4). Активные вещества электродов представляют собой относительно жесткую пористую электронопроводящую массу с диаметром пор 1,5 мкм у PbO2 и 5…10 мкм у губчатого свинца. Объемная пористость активных веществ в заряженном состоянии – около 50%.
RН

I
+ ─
Pb → Pb2+
Pb4+→ Pb2+
↑
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 767; Нарушение авторских прав?; Мы поможем в написании вашей работы!