
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплота(энергия) взрыва некоторых взрывчатых веществ
|
|
|
|
И продуктов взрыва
Значения теплот образования взрывчатых веществ
| Вещество | Химическая формула | Теплота образования Q, 
|
| Гексоген | 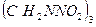
| -20,9 |
| Гремучая ртуть | 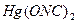
| -65,4 |
| Нитроглицерин | 
| 82,7 |
| Тэн | 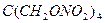
| |
| Тротил | 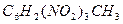
| |
| Двуокись углерода | 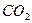
| 94,5 |
| Окись углерода | 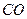
| 26,4 |
| Вода(пар) | 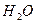
| 57,7 |
| Вода(жидкость) | 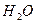
| 67,5 |
| Закись азота | 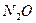
| -17,7 |
Продолжение таблицы 4
| Окись азота | 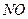
| -21,6 |
| Двуокись азота | 
| -4,1 |
| Аммиак | 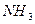
| 10,5 |
| Метан | 
| 18,4 |
| Простые вещества | 
|
Примечание: знак (+) при значении теплоты образования соответствует тепловому эффекту с выделением тепла, знак (-) – с поглощением тепла.
В качестве примера оценим теплоту взрыва тэна. Реакция взрывчатого превращения тэна приведена выше. Теплота образования тэна и продуктов взрыва: 3 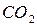 составляет
составляет 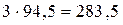 ккал
ккал
2 
 ккал
ккал
4 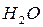
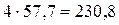 ккал
ккал
2 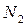
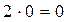 ккал
ккал
Всех продуктов 567,1 ккал
Тэна 123 ккал
Теплота взрыва тэна
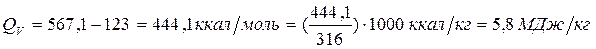
Значения 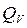 ряда ВВ приведены в табл. 5.
ряда ВВ приведены в табл. 5.
Таблица 5
| Взрывчатое вещество | Плотность ВВ r, 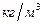
| Теплота взрыва 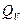 , , 
|
| Аммотол 80/20 (80% нитрата аммония + 20% ТНТ) | 2,65 | |
| Гексоген | 5,36 | |
| Гремучая ртуть | 1,79 | |
| 60%-ый нитроглицериновый динамит | 2,71 | |
| Нитроглицерин | 6,70 | |
| Октоген | 5,68 | |
| Октол (70% октана + 30% ТНТ) | 4,50 | |
| Пластическое ВВ (90% нитроглицерина + 7,9% нитроцеллюлозы + 0,9% щёлочи + 0,2% воды) | 4,52 | |
| Тринитротолуол (тротил) – ТНТ | 4,52 | |
| Тетрил | 4,52 | |
| Тэн | 5,80 | |
| Тринотал (80% ТНТ + 20% аллюминия) | 7,41 | |
| Торпекс (42% гексогена + 40% ТНТ + 18% аллюминия) | 7,54 |
Теплоту взрыва ВВ определяют также экспериментально на специальной калориметрической установке (калориметрической бомбе). Величина 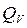 является критерием мощности взрыва.
является критерием мощности взрыва.
Важной характеристикой взрыва является скорость распространения взрывчатого превращения. В зависимости от величины этой скорости различают дефлаграционное (дозвуковое) горение и детонацию.
Дефлаграционное горение (от лат. deflagratio – сгорание дотла) подразделяется на ламинарное, характеризуемое постоянной, относительно небольшой обычно от долей сантиметра до нескольких метров в секунду скоростью распространения пламени, и турбулентное, когда эта скорость со временем прогрессивно возрастает. При увеличении скорости распространения пламени до величин порядка нескольких десятков и сотен метров в секунду, но не превышающих скорость звука в данной среде, имеет место взрывное горение, а само явление называется дефлаграционным взрывом.
При детонации процесс взрывчатого превращения идёт с максимально возможной для данного вещества скоростью, превышающей скорость звука. Скорость детонации является определённой константой каждого ВВ. В условиях детонации достигается максимальное разрушительное действие взрыва.
В последнее время в промышленности, на транспорте, в быту имеет место широкое применение углеводородных жидких и газообразных топлив.
Горение горючих газов (пропан, этан, этилен, бутан, бутилен, метан и др.) имеет определенные особенности. Эти вещества отличает, во-первых, высокая энерговооруженность, во-вторых, высокая температура горения, в-третьих, способность создавать не только пожароопасные, но и взрывоопасные газовоздушные смеси.
Целый ряд горючих газов определяется формулой  . При взрыве газовоздушных смесей, образованных такими газами, реакция взрывчатого превращения имеет вид:
. При взрыве газовоздушных смесей, образованных такими газами, реакция взрывчатого превращения имеет вид:
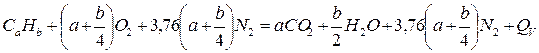 (1.39)
(1.39)
Данное уравнение является важным частным случаем уравнения (1.33) (при значении величин c=d =0).
Следует отметить, что при испарении легковоспламеняющихся горючих жидкостей, например, ацетона  , метилового
, метилового 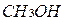 и этилового
и этилового 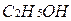 спиртов также могут образоваться взрывоопасные паровоздушные смеси. Реакция взрывчатого превращения таких смесей рассчитывается по уравнению (1.33).
спиртов также могут образоваться взрывоопасные паровоздушные смеси. Реакция взрывчатого превращения таких смесей рассчитывается по уравнению (1.33).
Расчёт теплоты взрыва горючих газов (и паров) проводится согласно закону Г.Г. Гесса. Значения теплоты образования рассматриваемых газов принимаются по термохимическим таблицам [7]. Значения теплоты образования часто встречающихся аммиака и метана приведены в табл.4.
При известных значениях теплоты образования горючих газов (и паров) и продуктов взрыва расчет искомой теплоты взрыва проводится по аналогии с расчетом теплоты взрыва конденсированных ВВ.
Более полно процессы горения и взрыва рассматриваются в последующих главах.
Глава 2. Физика горения
§ 2.1. Классификация горючих веществ и материалов.
Особенности горения твердых веществ, горючих
жидкостей, газов и пылей
Возможность возникновения горения определяется одновременным появлением необходимых условий: наличие горючей среды, окислителя и источника зажигания.
Следует отметить, что по горючести (способности к горению) вещества и материалы подразделяются на три группы: негорючие – то – есть не способные к горению в воздухе; трудногорючие – способные возгораться в воздухе от источника зажигания, но не способные самостоятельно гореть после его удаления; горючие – способные самовозгораться, а также возгораться от источника зажигания и самостоятельно гореть после его удаления. Среди горючих веществ выделяют легковоспламеняющиеся, способные воспламеняться от кратковременного (до 30 сек.) воздействия источника зажигания с низкой энергией (пламя спички, тлеющая сигарета, искра и т.п.).
Горючее вещество и окислитель составляют горючую систему. Горючие системы, в которых горючее вещество и окислитель равномерно перемешаны друг с другом (например, смеси горючих газов, паров с воздухом), называются химически однородными. Горение таких смесей именуют гомогенным. Горючие системы, в которых горючее вещество и окислитель имеют поверхность раздела (твердое вещество, жидкость) – химически неоднородны. Горение на поверхности таких веществ принято называть гетерогенным.
В процессе горения наблюдаются две стадии: создание молекулярного контакта между горючим и окислителем (физическая) и взаимодействие молекул с образованием продуктов реакции (химическая). Вторая стадия наступает только при условии достижения молекулами энергетически или химически возбужденного (активного) состояния. Возбуждение, или активизация молекул при горении происходит за счет их нагревания.
В зависимости от природы источника тепла различают воспламенение (зажигание) и самовоспламенение горючего вещества. При воспламенении часть горючего вещества нагревается тепловым источником, привнесенным извне; при самовоспламенении повышение температуры происходит за счет внутренней энергии самого вещества. Так, причиной самовоспламенения торфа являются биологические и химические процессы, возникающие при определенной влажности. Способностью к самовоспламенению обладает целый ряд веществ.
Время полного сгорания единицы массы любого вещества tг складывается из времени, необходимого для возникновения физического контакта между горючим веществом и кислородом воздуха tф (в случае гомогенного горения величина tф называется временем смесеобразования, а в случае гетерогенного – временем диффузии кислорода из воздуха к твердой поверхности горения) и времени протекания самой химической реакции горения tх, то есть tг=tф+tх. В зависимости от соотношения tф и tх различают диффузионное и кинетическое горение.
При горении химически неоднородных горючих систем кислород воздуха диффундирует сквозь продукты сгорания к горючему веществу и затем вступает с ним в химическую реакцию. Время tф значительно больше tх и практически tг @ tф. Такое горение называется диффузионным.
Если время tф<<tх, то можно принять tг @ tх. Такое горение называется кинетическим. Так горят химически однородные горючие системы, в которых молекулы кислорода равномерно перемешаны с молекулами горючего вещества, и не затрачивается время на смесеобразование.
Если продолжительность химической реакции и физическая стадия процесса горения соизмеримы, то горение протекает в так называемой промежуточной области, в которой на скорость горения влияют как химические, так и физические факторы.
Горение любого материала происходит в газовой или паровой фазе. Жидкие и твердые горючие материалы при нагревании переходят в другое состояние – газ или пар, после чего воспламеняются. При установившемся горении зона реакции выполняет роль источника воспламенения для остального горючего материала.
Область газообразной среды, в которой интенсивная химическая реакция вызывает свечение и тепловыделение, называется пламенем. Пламя является внешним проявлением интенсивных реакций окисления вещества. При горении твердых веществ наличие пламени не обязательно. Один из видов горения твердых веществ – тление (беспламенное горение), при котором химические реакции идут с небольшой скоростью, преобладает свечение красного цвета и слабое тепловыделение. Пламенное горение всех видов горючих материалов и веществ в воздушной среде возможно при содержании кислорода в зоне пожара не менее 14% по объему, а тление горючих твердых материалов продолжается до содержания кислорода ~ 6%.
Таким образом, горение – это сложный физико-химический процесс.
Современная теория горения основана на следующих положениях. Сущность горения состоит в отдаче окисляющимся веществам валентных электронов окислителю. В результате передачи электронов изменяется структура внешнего (валентного) электронного уровня атома. Каждый атом при этом переходит в наиболее устойчивое в данных условиях состояние. В химических процессах электроны могут полностью переходить из электронной оболочки атомов одного вида в оболочку атомов другого вида. Для получения представления о данном процессе рассмотрим несколько примеров.
Так, при горении натрия в хлоре атомы натрия отдают по одному электрону атомам хлора. При этом на внешнем электронном уровне атома натрия оказывается восемь электронов (устойчивая структура), а атом, лишившийся одного электрона, превращается в положительный ион. У атома хлора, получившего один электрон, внешний уровень заполняется восьмью электронами, и атом превращается в отрицательный ион. В результате действия электростатических сил происходит сближение разноименно заряженных ионов и образуется молекула хлорида натрия (ионная связь)
Na + + C1 - → Na + C1-
В других процессах электроны внешних оболочек двух различных атомов как бы поступают в «общее пользование», стягивая тем самым атомы в молекулы (ковалентная связь)
....
H ∙ + · C1: → H: C1:
˙˙ ˙˙
Атомы могут отдавать в «общее пользование» один и более электронов.
В качестве примера на рис.2 приведена схема образования молекулы метана из одного атома углерода и четырех атомов водорода. Четыре электрона атомов водорода и четыре электрона внешнего электронного уровня атома углерода поступают в общее пользование, атомы «стягиваются» в молекулу.
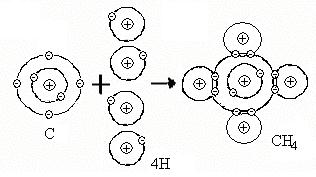
Рис.2. Схема образования молекулы метана
Учение о горении имеет свою историю. Среди ученых, исследовавших процессы горения, необходимо отметить А.Н. Баха и К.О. Энглера, разработавших перекисную теорию окисления, согласно которой при нагревании горючей системы происходит активация молекулы кислорода путем разрыва одной связи между атомами.
O2 → -O-O-
молекула активная молекула
 Активная молекула кислорода легко вступает в соединение с горючим веществом и образует соединение типа R-O-O-R (перекиси) и R-O-O-H (гидроперекиси); здесь R-символ радикала. Радикалы- частицы (атомы или атомные группы), обладающие неспаренными электронами, например,
Активная молекула кислорода легко вступает в соединение с горючим веществом и образует соединение типа R-O-O-R (перекиси) и R-O-O-H (гидроперекиси); здесь R-символ радикала. Радикалы- частицы (атомы или атомные группы), обладающие неспаренными электронами, например,  ,
, 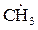 , и др. Пример такой реакции:
, и др. Пример такой реакции:
CH4 + -O-O- → 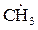 -O-O-
-O-O- 
гидропероксид метила
Энергия разрыва связи -О-О- в перекисях и гидроперекисях значительно ниже,чем в молекуле кислорода О2, поэтому они очень реакционны. При нагревании они легко распадаются с образованием новых веществ или радикалов. При этом выделяется тепло.
Дальнейшее развитие учения о горении связано с трудами Н.Н. Семенова, создавшего теорию цепных реакций горения, позволившую глубже проникнуть в физику явления и объяснить различные режимы горения, в том числе самовоспламенение, дефлаграционное горение и горение, приводящее к взрыву. Кроме того, отличие современного представления о механизме горения от перекисной теории состоит в том, что начальной фазой процесса является не активация молекул кислорода, а активация молекул окисляющегося вещества [1,6].
Цепными называются реакции, идущие через ряд стадий (через ряд промежуточных реакций), в которых образуются промежуточные соединения со свободными валентностями и, так называемые, активные центры, являющиеся зародышами последующих быстропротекающих процессов.
Известно, что при освещении смеси водорода с хлором молекула хлора, поглощая квант световой энергии hv, распадается на атомы. Атомы хлора практически мгновенно вступают в реакцию с водородом, в результате происходит взрыв смеси. Активизация одной молекулы хлора должна была вызвать образование двух молекул HC1
..
C12 + hυ = C1 + C1
..
C1 + C1 + H2 = 2HC1
Однако в действительности образуется ~ 105 молекул HC1.Такое явление можно объяснить, если предположить, что при взаимодействии атома хлора с водородом образуется активный продукт, который вступая во вторичные реакции, возрождается и может продолжить реакцию. Данному предположению соответствует следующая схема реакции:
..
I. C12 + hυ = C1 + C1 первичная реакция
..
II. C1 + H2 = HC1 + H
..
III. H + C12 = HC1 + C1
..
C1 + H2 = HC1 + H развитие цепи
..
H + C12 = HC1 + C1 и т.д.
..
IV. C1 + C1 = C12 обрыв цепи
..
V. H + H = H2
Активизация одной молекулы C12 (I) вызывает появление двух атомов хлора - активных центров цепной реакции. Каждый из них дает начало своей реакции, в которой активный центр непрерывно восстанавливается (II,III). Цепь может обрываться при столкновении атомов хлора (IV) или атомов водорода (V). Для простоты изложения выше приведена одна цепь превращений, образованная одним атомом хлора; вторая цепь – аналогична первой.
Цепные реакции могут быть разветвляющимися и не разветвляющимися. Пример неразветвляющейся цепи – рассмотренная реакция взаимодействия хлора с водородом. В разветвляющейся цепной реакции каждый активный центр порождает два или более новых активных центра. Один из центров будет продолжать цепь, второй – начнет новую. Примером такой реакции может служить реакция водорода с кислородом, протекающая при температуре ~ 900ºС.
.
I. O2 + H2 = 2OH цепь
..
II. OH +H2 = H2O +H
...
III. H + O2 = OH + O разветвление цепи
...
IV. O + H2 = OH + H и т.д.
.
V. H + O2 + M = H2O + M обрыв цепи
(М- молекула вещества, не участвовавшего в реакции)
В результате реакций III и IV образуются по два активных центра; следовательно, цепь разветвляется. Цепные реакции лежат в основе многих химических реакций, в том числе и горения.
Рассмотрим кратко качественную картинку горения горючих газов, жидкостей, пылей и твердых веществ.
Как отмечалось в § 1.7, по скорости распространения пламени горение подразделяют на дефлаграционное, протекающее с дозвуковыми скоростями, и детонацию, распространяющуюся со сверхзвуковой скоростью.
Горение химических взрывчатых веществ, а также газовоздушных и пылевоздушных смесей, связанное с взрывчатыми превращениями, рассматривается в главах 4, 5. Ниже основное внимание уделяется горению при пожарах, протекающему, как правило, в режиме дефлаграционного горения и с относительно небольшими скоростями. Например, скорость распространения пламени в начале горения твердых материалов составляет ~ 0,1 м/с (средние данные), горючих жидкостей ~ 0,5 м/с, бензина ~ 2,4 м/с, горючих газов (пропан, этан, бутан) ~ 6-12 м/с. Горение газов, жидкостей и твердых веществ имеет определенные особенности.
 Горение газов. Процесс горения начинается в результате воспламенения (либо самовоспламенения) горючего вещества. Инициирование горения газовой смеси в одной точке приводит к нагреву близлежащих слоев, в них также начинается химическое превращение. Сгорание этих слоев влечет за собой инициирование горения следующих слоев и так до полного выгорания горючей смеси. Таким образом, при зажигании горючая смесь сгорает послойно.
Горение газов. Процесс горения начинается в результате воспламенения (либо самовоспламенения) горючего вещества. Инициирование горения газовой смеси в одной точке приводит к нагреву близлежащих слоев, в них также начинается химическое превращение. Сгорание этих слоев влечет за собой инициирование горения следующих слоев и так до полного выгорания горючей смеси. Таким образом, при зажигании горючая смесь сгорает послойно.
Зона, в которой происходит химическое превращение и интенсивный разогрев сгорающего газа, перемещается по смеси, обеспечивая распространение пламени. Ширина (толщина) фронта пламени газовых смесей при атмосферном давлении составляет несколько десятых долей миллиметра, рис. 3. Аналогично горят парообразные горючие смеси.
Рис.3. Распределение температуры в газовой смеси, по которой распространяется пламя
Следует отметить, что при перемещении фронта пламени температура несгоревшей части горючей смеси возрастает, так как происходит передача тепла теплопроводностью, диффузией нагретых молекул и излучением, а также вследствие повышения давления смеси. При этом происходит увеличение скорости движения пламени. Так как скорость химической реакции при высокой температуре велика, горение такой смеси происходит чрезвычайно быстро и может носить характер взрыва.
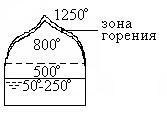 Горение горючих жидкостей происходит в газовой фазе. В результате испарения над поверхностью жидкости образуется паровая подушка, взаимодействие которой с кислородом воздуха обеспечивает формирование зоны горения. Упрощенная схема горения показана на рис. 4.
Горение горючих жидкостей происходит в газовой фазе. В результате испарения над поверхностью жидкости образуется паровая подушка, взаимодействие которой с кислородом воздуха обеспечивает формирование зоны горения. Упрощенная схема горения показана на рис. 4.
Зоной горения является тонкий светящийся слой газов, в который с поверхности жидкости поступают горючие пары, а из воздуха диффундирует кислород. В результате горения происходит выгорание жидкости.
Рис. 4. Схема горения жидкости
Горение твердых веществ отличается наличием стадии разложения и газификации. Под воздействием тепла происходит нагрев твердой фазы, сопровождающийся разложением и выделением газообразных продуктов. Затем эти продукты воспламеняются и сгорают. Тепло от образовавшегося пламени воздействует на поверхность твердого вещества, вызывая поступление в зону горения новых порций горючих газов. При горении обычно наблюдаются следующие зоны:
- прогрева конденсированной фазы;
- пиролиза, или реакционной зоны в конденсированной фазе, в которой образуются газообразные летучие вещества;
- предпламенной в газовой фазе, в которой происходит образование горючей смеси;
- пламени, или реакционной зоны в газовой фазе, в которой происходит превращение продуктов пиролиза в газообразные продукты горения.
В качестве примера на рис.5 представлена схема процесса горения древесины от подогрева до угольной фазы. Основу древесины составляет клетчатка(C6H10O5), которая содержит значительное количество собственного кислорода. При подогреве молекула клетчатки становиться непрочной и с дальнейшим повышением температуры может распасться.
Установлено, что при температуре от 0º < t < 100º нагрев древесины происходит без видимых изменений, при 100º < t < 150º происходит испарение влаги, при 150º < t < 300º имеет место нарастающий процесс разложения древесины с выделением горючих газов, при 300º < t < 500º происходит постепенное замедление процесса разложения внутри обугленной частицы, при 500º < t < 800º - горение углей с выделением CO и CO2.
По мере удаления из частиц летучих веществ, светящееся пламя начинает спадать и, наконец, исчезает совсем. Таким образом древесина не горит с поверхности, а разлагается с нее. Горит топливный газ. В конце процесса горения остаются углеродные частицы, окруженные полупрозрачным синеватым пламенем окиси углерода воздуха. В результате интенсивного окисления кислородом воздуха углеродные частицы быстро сгорают и превращаются в золу.
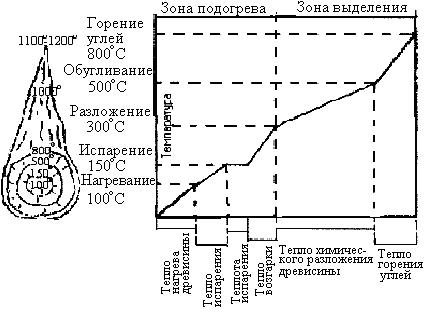
Рис. 5. Схема горения древестны
Горение пылей. Пыль – это дисперсная система, состоящая из газообразной дисперсионной среды и твердой дисперсной фазы. Обычно дисперсионной средой является воздух, а дисперсной фазой – твердое вещество в раздробленном состоянии с частицами менее 100 мкм.
Пыль может находиться в осевшем и взвешенном состоянии. Осевшая пыль называется аэрогелем (пыль – гель); находящаяся во взвешенном состоянии – аэрозолем (пыль – аэровзвесь). Аэрогели и аэровзвеси являются гетерогенными системами. Аэровзвеси по своим свойствам занимают промежуточное положение между аэрогелями и гомогенными газовоздушными смесями. Аэровзвеси сходны с аэрогелями тем, что обе системы являются гетерогенными дисперсными системами с одинаковой твердой фазой; с газовоздушными смесями – тем, что горение большинства из них происходит с большой скоростью (в форме взрывного горения).
Склонность аэровзвесей к слипанию частиц и их осаждению обуславливает меньшую вероятность взрыва по сравнению с газовоздушными смесями; кроме того, для воспламенения аэровзвеси требуется более высокая энергия зажигания (примерно на два порядка выше, чем для газовоздушной смеси).
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 4693; Нарушение авторских прав?; Мы поможем в написании вашей работы!