
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон сохранения энергии. Закон сохранения энергии является, пожалуй, одним из самых известны
|
|
|
|
Закон сохранения энергии является, пожалуй, одним из самых известны.
Энергия – физическая величина, характеризующая общую количественную меру различных форм движения материи.
Закон сохранения энергии: полная энергия изолированной системы постоянна при любых процессах внутри этой системы: Е = const.
В приведенной формулировке закона сохранения энергии остановимся несколько подробнее на смысле выражения «при любых процессах внутри этой системы». Это означает, во-первых, что отдельные части системы могут обмениваться между собой энергией, но при этом суммарное значение их энергии не изменяется. Во-вторых, энергия одного вида может переходить в энергию другого вида. Например, механическая – во внутреннюю, внутренняя – в электрическую, электрическая – в световую и т.д. Конкретной иллюстрацией подобных превращений могут быть процессы, например, в такой системе: некоторая твердая плита и падающее на неё твердое тело. По мере падения тела его начальная потенциальная энергия превращается в кинетическую энергию. В момент удара возникает деформация тела и плиты (энергия деформации). При этом часть механической энергии переходит во внутреннюю энергию. Если поверхность плиты обладает пьезоэлектрическими свойствами, то может появиться электрический потенциал (электрическая энергия). Вот некоторый, далеко не полный, перечень возможных энергетический превращений.
Изменяться полная энергия системы может только, если эта система является открытой. Тогда за счет энергообмена с внешней средой (отдача или получение энергии в виде механической, электрической, тепловой, световой и проч.) полная энергия системы уменьшается или возрастает.
Закон сохранения энергии верен не только для физических процессов, но и для любых других, например, химических. Так в термохимии (раздел химии в котором рассматриваются тепловые эффекты реакций) существуют два закона, известные науке как закон Лаваузье-Лапласа (1780 г.) и закон Гесса (1840 г.). (Лавуазье Антуан (1743-1794), французский химик, Лаплас Пьер (1749 - 1827), французский астроном, физик, математик. Гесс Герман Иванович (1802 - 1850), швейцарский химик, родился в Женеве, более 20 лет работал в России, был избран академиком Петербургской Академии наук).
Прежде, чем дать формулировки законов термохимии, следует определить те понятия (физические величины), которые фигурируют в этих законах.
Тепловой эффект реакции – физическая величина, определяющая количество теплоты, выделяющейся или поглощающейся в результате протекания химической реакции. Измеряется в джоулях, килоджоулях и т.п.
Теплота образования сложного вещества из простых (разложение сложного вещества на простые) – физическая величина, равная тепловому эффекту реакции образования (разложения) 1 моль сложного вещества из соответствующих простых (на простые). Измеряется в джоулях на моль, килоджоулях на моль и т.п.
Закон Лавуазье-Лапласса: теплота разложения сложного вещества на простые равна теплоте его образования из тех же простых веществ при тех же условиях, но взятой с противоположным знаком.
Например, при стандартных условиях теплота образования воды из молекул Н2 и О2 составляет +238 кДж/моль. То есть при образовании 1 моль воды из водорода и кислорода при стандартных условиях выделяется 238 кДж теплоты. Теплота разложения воды на кислород и водород составляет минус 238 кДж/моль, т.е. на разложение 1 моль воды на водород и кислород затрачивается 238 кДж.
Закон Гесса: тепловой эффект реакции зависит только от начального и конечного состояния системы (вещества) и не зависит от промежуточных стадий процесса.
Так, для реакции 2С(графит) + О2 = 2СО тепловой эффект Q1 = 221 кДж,
а для реакции 2СО + О2 = 2СО2 ¾ Q2 = 566 кДж, Суммарный тепловой эффект окисления 2 моль графита до углекислого газа при стандартных условиях составляет: Q3 = 221 +566 = 787 кДж, а в пересчете на 1 моль ¾ Q4 = 393,5 кДж. Тепловой эффект реакции непосредственного окисления графита С(графит) до углекислого газа (СО2) по уравнению С(графит) + О2 = СО2 при тех же условиях так же составляет Q4 = 393,5 кДж.
Понятно, что оба эти закона являются частным случаями сохранения энергии. На основании закона Гесса можно записать выражение для расчета тепловых эффектов химических реакций:
Qреак =  Q fj (продукты реакции) -
Q fj (продукты реакции) - 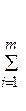 Q fi (исходные вещества), (14)
Q fi (исходные вещества), (14)
где: Qреак – тепловой эффект реакции; Q fj (продукты реакции) – теплоты образования продуктов реакции; Q fi (исходные вещества) – теплоты образования исходных веществ.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 408; Нарушение авторских прав?; Мы поможем в написании вашей работы!