
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методические рекомендации. Семинар 4. Химическое равновесие
|
|
|
|
План занятия
Семинар 4. Химическое равновесие
4 часа
Цель семинара:
1. Познакомиться с понятием термодинамического и химического равновесий, а так же с принципом консервативности Ле-Шателье-Брауна.
2. Научиться решать задачи на вычисление равновесных концентраций реагирующих веществ и смещение равновесия.
1. Изучение теоретических основ термодинамического и химического равновесий.
2. Решение задач на расчёт химических равновесий.
3. Подведение итогов семинара.
Основная литература
1. Зайцев О.С. Основы химической термодинамики. Изд. 3-е. М.: Химия, 2007. – с. 55-61.
2. Зимон А.Д. Физическая химия. Изд. 3-е. М.: Агар, 2006. – с. 64-80.
Дополнительная литература
1. Киреев В.А. Курс физической химии. – М.: Химия, 1995.
2. Физическая химия. / Краснов К.С., Воробьев Н.К., Годнев И.Н. и др. Под ред. К.С. Краснова. – М.: Высшая школа, 1995.
3. Климов И.И., Филько А.И. Сб. вопросов и задач по физической и коллоидной химии. – М.: Просвещение, 2003.
При подготовке к теме семинара следует обратить внимание на различные виды равновесий, а также на практическое применение принципа консервативности Ле-Шателье-Брауна. При характеристике химического и биологического равновесий необходимо ответ подтверждать примерами. Решая расчетные задачи использовать умение логически мыслить и обобщать опытные данные.
Вопросы для самоподготовки:
1. Какие реакции называются обратимыми? Необратимыми? Приведите примеры тех и других.
2. Какое состояние называют равновесным? Виды равновесных состояний.
3. Что означает состояние равновесия? Как можно определить, что в системе равновесие наступило?
4. Что определяет константа химического равновесия? От каких факторов она зависит? Не зависит?
5. Напишите математическое выражение закона действующих масс применительно к обратимым идеальным однородным химическим системам и реальным.
6. В каких случаях обратимые реакции протекают до конца? Объясните это с точки зрения закона действующих масс.
7. Сформулируйте принцип смещения химического равновесия Ле Шателье.
8. Как смещается химическое равновесие при изменении температуры, концентрации, давления?
9. В каком направлении смещается равновесие
2СО + О2 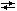 2СО2, ∆H = -566,4 кДж
2СО2, ∆H = -566,4 кДж
при изменении давления и температуры?
10. В какую сторону сместится равновесие реакции
СО2 + С 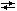 2СО, ∆H = 172,6 кДж
2СО, ∆H = 172,6 кДж
при повышении температуры? Что произойдет в системе при увеличении давления?
11. Выразите математически Кр для следующих реакций, протекающих по уравнениям:
а) FeO + H2 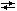 Fe + H2Oг;
Fe + H2Oг;
б) 2HgO 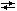 2Hg + O2;
2Hg + O2;
в) 2Cu + O2 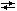 2CuO
2CuO
12. Как повлияет повышение давления при неизменной температуре на равновесие следующих систем:
а) 2HBr 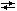 H2 + Br2, ∆H = 70,3 кДж;
H2 + Br2, ∆H = 70,3 кДж;
б) 2СО + О2 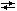 2СО2, ∆H = - 566,4 кДж;
2СО2, ∆H = - 566,4 кДж;
в) N2 + O2 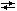 2NO, ∆H = 180,9 кДж?
2NO, ∆H = 180,9 кДж?
13. Каким путем можно повысить выход NO2 при реакциях, идущих по уравнениям:
а) 2NO + O2 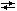 2NO2, ∆H = -113 кДж;
2NO2, ∆H = -113 кДж;
б) N2O4 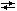 2NO2, ∆H = 58.2 кДж?
2NO2, ∆H = 58.2 кДж?
14. Как можно увеличить процентное содержание PCl3 в равновесной системе, выраженной уравнением:
PCl5 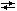 PCl3 + Cl2; ∆H = 92,5 кДж?
PCl3 + Cl2; ∆H = 92,5 кДж?
Задачи для самостоятельного решения:
1. Константа равновесия реакции образования HCl при некоторой температуре равна единице. Определите состав(в молярных долях) равновесной реакционной смеси, полученной из водорода объемом 2 л и хлора объемом 3 л.
2. При 50 °С и давлении 0,348∙105 Па степень диссоциации N2O4 на NO2 равна 63%. Определите значение Кр и Кс.
3. В закрытом сосуде при постоянной температуре смешано 2 моль азота и 6 моль водорода. В результате реакции к моменту равновесия прореагировало 10% первоначального количества азота. Как изменилось давление в системе по сравнению с первоначальным?
4. Константа равновесия гомогенной системы:
СО(г) + Н2О(г) 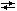 СО2 (г) +Н2 (г)
СО2 (г) +Н2 (г)
при 850°С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации были равны: [СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л.
5. В гомогенной газовой системе А + В 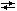 С + D равновесие установилось при концентрациях [В] = 0,05 моль/л и [С] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В.
С + D равновесие установилось при концентрациях [В] = 0,05 моль/л и [С] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В.
6. Равновесие гомогенной системы:
4HCl(г) + О2 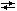 2Н2О(г) + 2Сl2 (г)
2Н2О(г) + 2Сl2 (г)
установилось при следующих концентрациях реагирующих веществ: [Н2О]р = 0,14 моль/л; [Сl2]р = 0,14 моль/л; [HCl]р = 0,20 моль/л; [О2]р = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода, а также Кс и Кр.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1139; Нарушение авторских прав?; Мы поможем в написании вашей работы!