
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методические рекомендации. Задачи для самостоятельного решения
|
|
|
|
План занятия
Семинар 2. Термохимия
Задачи для самостоятельного решения
1. Определите изменение внутренней энергии при изобарическом (1,013∙105 Па) испарении воды массой 100 г при 150 °С, если объемом жидкой воды пренебречь. Теплота испарения воды при 150 °С равна 2112,66 Дж/г.
2. Одноатомный газ объемом 5 л (условия нормальные) нагревают до 600 °С при постоянном объеме. Каковы конечное давление и количество затраченной теплоты?
3. Какое количество теплоты необходимо для изохорического нагревания углекислого газа массой 50 г в интервале температур от 300 до 400 °С, если СV = 40,2 Дж/моль.
4. При действии кислоты на металл выделился водород объемом 0,007 м3 при давлении в 1,013∙105 Па. Определите работу, произведенную газом против атмосферного давления.
5. Азот количеством вещества 5 моль при 100 °С занимал объем 0,025 м3. При нагревании газа до 200 °С было затрачено 14650 Дж. Определите Ср и конечный объем, если давление газа при этом не изменилось.
6. 1моль одноатомного газа, взятого при 25 °С и давлении 1,013∙105 Па, адиабатически расширился до 0,05 м3. Каковы будут конечные давление и температура?
4 часа
Цель семинара:
1. Изучить закон Гесса и следствия из него.
2. Научиться решать задачи, связанные с термохимическими расчетами.
1. Изучение закона Гесса и следствий из него.
2. Решение термохимических задач
3. Изучение термохимии в средней школе.
4. Подведение итогов семинара.
Основная литература
1. Зайцев О.С. Основы химической термодинамики. Изд. 3-е. М.: Химия, 2007. – с. 11-21.
2. Зимон А.Д. Физическая химия. Изд. 3-е. М.: Агар, 2006. – с. 32-38.
Дополнительная литература
1. Карапетьянц М.Х. Введение в теорию химических процессов. – М.: Высшая школа, 1980.
2. Смирнова Н.А. Физическая и коллоидная химия. – М.: Высшая школа, 2003.
3. Физическая химия. / К.С. Краснов, Н.К. Воробьев, И.Н. Годнев и др. Под ред. К.С. Краснова. – М.: Высшая школа, 1995.
4. Физическая химия. / Б.П. Никольский, Н.А. Смирнова, М.Ю. Панов и др.; Под ред. Б.П. Никольского. – М.: Химия, 1987.
Изучение тепловых эффектов, сопровождающих химические реакции – важная научная и практическая задача. Следовательно, при подготовке к семинару необходимо не только знать формулировки основных законов термохимии, но и уметь применять их для решения термохимических задач. Следует обратить внимание также на то, что формулировки следствий из закона Гесса могут быть различными, но они не противоречат друг другу.
Вопросы для самоподготовки:
1. Что называется тепловым эффектом химической реакции?
2. Сформулируйте закон Гесса и следствия, вытекающие из него. Каково значение этого закона?
3. Объясните, почему закон Гесса есть частный случай первого закона термодинамики.
4. Какие уравнения называют термохимическими? Чем они отличаются от обычных?
5. Применяя математическое выражение первого закона термодинамики, покажите, что тепловой эффект при постоянном давлении есть изменение энтальпии, а тепловой эффект при постоянном объеме — изменение внутренней энергии химической реакции.
6. Какие химические реакции называют экзотермическими и эндотермическими? Приведите примеры. Каким математическим знаком обозначают теплоту, подведенную к системе в термодинамике и в термохимии; теплоту, выделенную системой?
7. Почему для конденсированных систем разница между ∆Н и ∆U мала, а для газообразных значительна? Напишите уравнение, выражающее связь между тепловым эффектом при постоянном давлении и тепловым эффектом при постоянном объеме.
8. Дайте определение понятиям «энтальпия образования», «энтальпия разложения», «энтальпия растворения», «энтальпия сгорания», «энтальпия нейтрализации».
9. Почему при определении теплот растворения на 1 моль различных растворенных веществ берется различное количество вещества растворителя?
10. Сформулируйте закономерности, установленные для теплот образования химических соединений.
11. Чем объяснить постоянство теплот нейтрализации сильной кислоты сильным основанием?
12. Одинаковый ли тепловой эффект будет, при: а) нейтрализации серной кислоты гидроксидом натрия; б) нейтрализации серной кислоты гидроксидом аммония. Дайте объяснение.
13. Будет ли наблюдаться выделение или поглощение теплоты при сливании разбавленных растворов:
а) хлорида калия и бромида натрия;
б) хлорида калия и нитрата серебра;
в) сульфата натрия и нитрата свинца;
г) хлорида кальция и нитрата натрия?
14. Как зависит тепловой эффект химической реакции от температуры? Напишите математическое выражение закона Кирхгофа. В каких случаях тепловой эффект химической реакции не зависит от температуры? Почему?
15. Что такое энергия связи? Энергия разрыва связи?
Задачи для самостоятельного решения:
1. Определите теплоту полного сгорания нитробензола, если его теплота образования равна 15,9 кДж.
2. Вычислите теплоту образования оксида Fe2O3, если известно, что при реакции
2Al + Fe2O3 = Al2O3 + 2Fe
на каждые 80 г восстанавливаемого оксида железа (III) выделяется 424,1 кДж.
3. Определите тепловой эффект основного процесса доменной печи:
Fe2O3 + 3CO = 2Fe + 3CO2
4. Реакция разложения карбоната кальция выражается уравнением:
СаСО3 = СаО + СО2; ∆H = 145,3 кДж
Сколько теплоты надо затратить для разложения СаСО3 массой 500 г?
5. Вычислите тепловой эффект реакции восстановления оксида FeO водородом, пользуясь следующими данными:
FeO + CO = Fe + CO2, ∆H = -13,19 кДж;
CO + 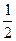 O2 = CO2, ∆H = -283,2 кДж;
O2 = CO2, ∆H = -283,2 кДж;
H2 + 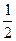 O2 = H2O г,
O2 = H2O г,  ∆H = -242 кДж.
∆H = -242 кДж.
6. Вычислите тепловой эффект реакции при 25 °С при постоянном давлении и при постоянном объеме. Реакции выражаются уравнениями:
а) SO2 + Cl2 = SO2Cl2 г;
б) CO + Cl2 = COCl2 г;
в) СН4 + O2 = 2СО + 2Н2.
7. Горение фосфора можно выразить уравнением:
4Р + 5О2 = 2Р2О5
Представьте этот процесс термохимическим уравнением, если известно, что при сгорании фосфора массой 1 г выделяется 24,7 кДж.
8. Теплота сгорания С2Н5ОН равна - 1367,7 кДж. Найдите теплоту образования этилового спирта, если при горении образуются углекислый газ и вода в жидком состоянии.
9. Напишите термохимическое уравнение реакции между СО и Н2, в результате которой образуется метан и пары воды. Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия?
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1632; Нарушение авторских прав?; Мы поможем в написании вашей работы!