
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методические рекомендации
|
|
|
|
План занятия
Семинар 3. Второй закон термодинамики
4 часа
Цель семинара:
1. Изучить второе начало термодинамики и его приложимость к живым организмам.
2. Научиться решать задачи с использованием математического аппарата, относящегося ко второму закону термодинамики.
1. Изучение теоретических основ второго закона термодинамики.
2. Решение расчётных задач.
3. Подведение итогов семинара
Основная литература
1. Зайцев О.С. Основы химической термодинамики. Изд. 3-е. М.: Химия, 2007. – с. 32-45.
2. Зимон А.Д. Физическая химия. Изд. 3-е. М.: Агар, 2006. – с. 51-62.
Дополнительная литература
1. Болдырев А.И. Физическая и коллоидная химия. – М.: Высшая школа, 2003.
2. Физическая химия. / Б.П. Никольский, Н.А. Смирнова, М.Ю. Панов и др. Под ред. Б.П. Никольского. – М.: Химия, 2007.
3. Физическая химия. / К.С. Краснов, Н.К. Воробьев, И.Н. Годнев и др. Под ред. К.С. Краснова. – М.: Высшая школа, 1995.
4. Чанг Р. Физическая химия с приложениями к биологическим системам. – М.: Мир, 1990.
При изучении II закона термодинамики следует обратить внимание на то, что этот закон, в отличие от первого закона не является строгим. От него возможны отклонения, как в микро, так и в макромаштабах. Следует также дать обоснованный ответ на вопрос: «Подчиняются ли живые организмы II закону термодинамики?» Как объясняются кажущиеся противоречия при применении этого закона к живым организмам? Необходимо знать все формулировки этого закона и уметь вывести его математическое выражение.
Вопросы и задачи для самоподготовки:
1. Приведите несколько формулировок второго закона термодинамики и напишите его математическое выражение.
2. Что такое КПД? Почему он всегда бывает меньше единицы?
3. В чем состоит значение второго закона термодинамики для физической химии и химической технологии?
4. В отличие от первого закона термодинамики, второй закон носит статистический (вероятностный) характер. Что это значит?
5. Что такое свободная и связанная энергия? 6. Что такое энтропия?
7. Как будет изменяться энтропия воды при ее переходе из твердого состояния в жидкое и из жидкого в парообразное?
8. Почему энтропия системы всегда больше нуля?
9. Напишите уравнения изменения энтропии для изотермических обратимых неизолированных, обратимых изолированных и изолированных необратимых процессов.
10. Почему несостоятелен вывод Клаузиуса о тепловой смерти Вселенной?
11. В чем состоит физический смысл изобарно-изотермического и изохорно-изотермического потенциалов? Напишите уравнения, показывающие связь между термодинамическими потенциалами и другими термодинамическими функциями.
12. Знак изобарно-изотермического потенциала позволяет судить о том, может ли данная реакция идти самопроизвольно, а его величина указывает, на какую глубину должна пройти реакция, чтобы система достигла равновесия. Выясните, какие из нижеприведенных реакций будут протекать в прямом, а какие - в обратном направлении. Какая из этих реакций будет ближе всего к равновесию в момент смещения эквимолярных количеств всех веществ, участвующих в реакции, а какая - дальше всего? Все вещества газообразные, температура и давление постоянны.
| Реакция | Изобарно-изотермический потенциал, (Дж/моль) |
а) SO2 + ½O2 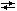 SO3
б) 2НС1 SO3
б) 2НС1 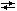 H2 +Cl2
в) CO + H2O H2 +Cl2
в) CO + H2O 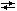 CO2 + H2
г) 2Н2 + O2 CO2 + H2
г) 2Н2 + O2 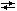 2H2O 2H2O
| -69920 +190500 -28889 -457617 |
13. Назовите три составные части тепловой машины. Что они собой представляют у паровоза? Тепловоза? Электровоза?
14. Что представляют собой холодильная машина и тепловой насос? Где они применяются?
15. Подчиняются ли живые организмы второму закону термодинамики? Ответ подтвердите примерами.
Задачи для самостоятельного решения:
1. Определите максимальную работу, которую можно получить, если к воде при 100 °С подводятся 4000 Дж теплоты, а температура конденсата 20 °С.
2. Сравните термодинамическую эффективность паровой машины и машины, работающей на ртутном паре, если котел первой имеет температуру 200 °С, второй 460 °С, а холодильник каждой из машин имеет температуру 30 °С.
3. Вода массой 100 г при 25 °С превращена в пар с температурой 150 °С и давлением 101300 Па. Вычислите изменение энтропии этого перехода, если удельная теплота испарения воды при 100 °С равна 2257 Дж/г, удельная теплоемкость воды 4,187 Дж/г∙К, а удельная теплоемкость водяного пара при давлении 101300 Па равна 1,968 Дж/г∙К.
4.Наидите изменение энтропии при переходе 3 моль кислорода от объема 33,6 л под давлением 202600 Па к объему 67,2 л под давлением 101300 Па. Молярная теплоемкость кислорода СР равна 29,37 Дж/моль∙К, температура постоянна.
5. Азот объемом 0,001 м3 смешан с кислородом объемом 0,002 м3 при 27 °С и давлении 1,013∙105 Па. Найти общее изменение энтропии системы.
6. В термостате поддерживается температура 96,6 °С. Температура воздуха в комнате 26,9 °С. Потеря теплоты через изоляцию термостата за некоторый промежуток времени составила 4187 Дж. Найти общее изменение энтропии.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 916; Нарушение авторских прав?; Мы поможем в написании вашей работы!