
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры
|
|
|
|
Технологических процессов
Исследование кинетики реакций и контроль
По ИК спектрампроб, последовательно отобранных в ходе какой-либо реакции, можно легко контролировать протекание многих органических реакций. Необходимым условием для этого является превращение в ходе реакции одних функциональных групп в другие, отличающиеся в ИК спектрах положением характеристических полос поглощения. Очевидно, что в ходе реакции интенсивность полосы поглощения функциональной группы исходного вещества уменьшается вплоть до полного исчезновения, а интенсивность полосы поглощения образующейся функциональной группы продукта реакции возрастает. А так как интенсивность полос поглощения в соответствии с законом Бугера-Ламберта-Бера пропорциональна концентрации вещества, то можно количественно определить содержание исходного вещества и продукта взаимодействия в реакционной смеси в любой момент реакции, и, следовательно, определить кинетические характеристики. Полосы поглощения, по которым осуществляется контроль протекания реакции, не должны накладываться на какие-либо другие. Оптимальной является ситуация, когда возможно определять интенсивность полос поглощения как исходных, так и конечных веществ. Но часто приходится оценивать кинетику реакции по характеристической полосе поглощения или исходного, или образующегося соединения.
а) Кинетику окисления п -ментола в п -ментон под действием хлорохромата пиридиния, нанесенного на оксид алюминия, можно оценивать как по уменьшению полосы поглощения группы ОН исходного терпенового спирта (рис. 8), так и по увеличению интенсивности полосы поглощения группы С=О образующегося кетона (рис. 9). Однако полоса поглощения группы ОН уширена, а ее положение несколько меняется в ходе реакции из-за изменения степени ассоциации (водородные связи!!!), так как уменьшается концентрация исходного п -ментола. Поэтому на практике скорость данной реакции измеряют по увеличению интенсивности полосы поглощения группы С=О п -ментона (~1710 см-1).
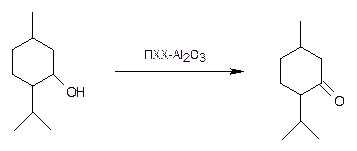
Экспериментально реакцию проводят в течение 2 часов в растворе гексана при перемешивании. Через каждые 10 минут из реактора отбирают пробы реакционной смеси, быстро отфильтровывают от твердого окислителя, заливают в спектрофотометрическую кювету и записывают ИК спектр в диапазоне 1690-1730 см-1. Интенсивность полосы поглощения группы С=О п -ментона (~1710 см-1) определяется автоматически с помощью компьютерной программы. Также с помощью специальной программы строится зависимость «концентрация п -ментона – время».
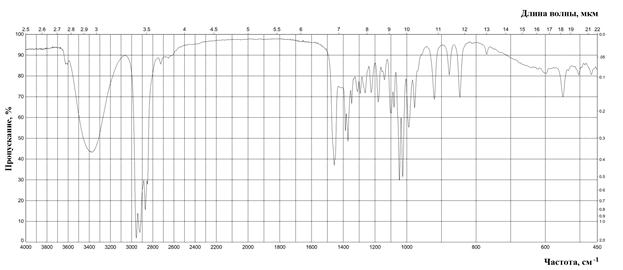
Рис. 8. ИК спектр п -ментола (тонкая пленка)
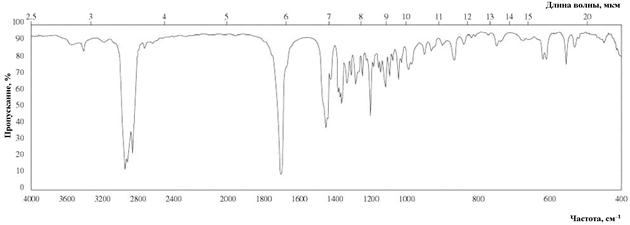
Рис. 9. ИК спектр п -ментона (тонкая пленка)
б) Для синтеза углеводородов строго заданного строения иногда используют фотохимическое расщепление С-С связи при α-углеродном атоме карбонильных соединений. При этом образуются ацильный и алкильный радикалы. Декарбонилирование ацильного радикала и рекомбинация возникающего радикала с другим алкильным радикалом приводят к созданию новой связи С-С в образующемся углеводороде. Реакция протекает при облучении УФ лампой при комнатной температуре в течение длительного времени. Например, образование дибензила из дибензилкетона требует около 18 часов. В качестве растворителя используется гексан.
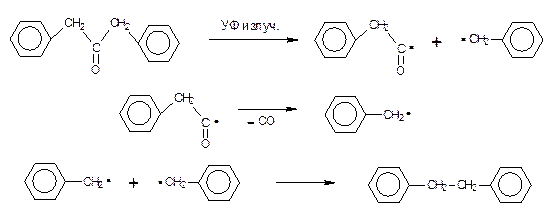
Кинетику этой реакции удобно исследовать ИК спектроскопически по уменьшению в ходе реакции интенсивности полосы поглощения группы С=О (~1720 см-1) исходного дибензилкетона (рис. 10), так как в этой области спектра и у продукта реакции (дибензил) (рис. 11), и у растворителя (гексан) отсутствуют собственные полосы поглощения.
Экспериментально в данном случае пробы реакционной смеси, отбираемые через 15-30 минут, без какой-либо обработки загружают в спектрофотометрическую кювету и записывают ИК спектр в диапазоне 1700-1750 см-1. Реакцию прекращают, когда интенсивность поглощения группы С=О примет минимальное значение и практически перестанет уменьшаться во времени.
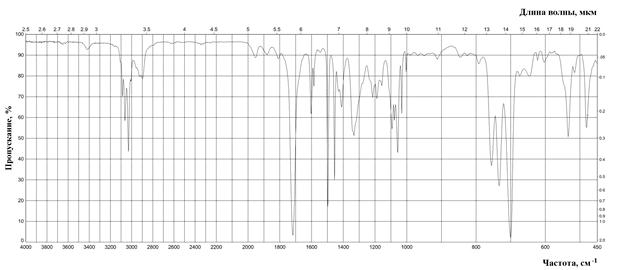
Рис. 10. ИК спектр дибензилкетона (жидкая пленка).
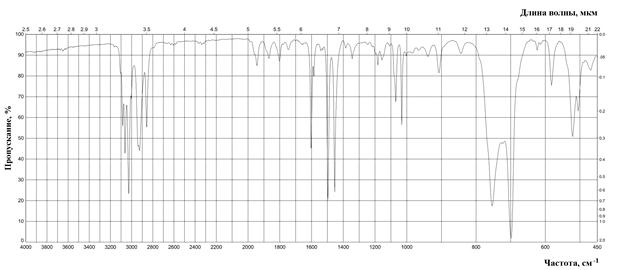
Рис. 11. ИК спектр дибензила (жидкая пленка).
Подход, аналогичный изучению кинетики химических реакций, используется в производственных условиях для контроля технологических процессов. В случае медленно протекающих реакций из реактора периодически отбирают пробы и методом ИК спектроскопии анализируют состав реакционной смеси (точнее - изменение концентрации исходного или конечного продуктов) в заводской лаборатории на стационарном спектрометре. Быстро протекающие процессы иногда удается контролировать с помощью непрерывно действующих автоматических ИК анализаторов, в которых спектрофотометрическая кювета соединяется с реактором таким образом, чтобы через нее постоянно проходил поток реакционной смеси. В реакторах периодических процессов это может быть соединяющий низ и верх аппарата трубопровод, через который реакционная смесь прокачивается циркуляционным насосом.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 781; Нарушение авторских прав?; Мы поможем в написании вашей работы!