
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стандартный электродный потенциал и константа равновесия реакции окисления — восстановления
|
|
|
|
Для обратимой окислительно-восстановительной полуреакции Ох + ne ↔ Red зависимость окислительно-восстановительного потенциала Е от активностей окисленной (Ох) и восстановленной (Red) форм выражается уравнением Нернста:
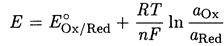
где - Е°Ох/Red - стандартный электродный потенциал. При 20 °С
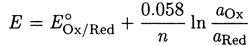
Если в окислительно-восстановительной полуреакции участвуют ионы водорода, то в уравнение Нернста входит активность ионов водорода:
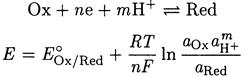
Окислительно-восстановительная реакция является сочетанием двух полуреакций. Для определения направления реакции необходимо найти разность стандартных потенциалов этих полуреакций. Если разность - положительное число, то это указывает на протекание реакции слева направо. При этом необходимо помнить, что обе полуреакции должны быть записаны в форме восстановления. Согласно соглашению о знаках электродных потенциалов (Стокгольм. 1953) термин «электродный потенциал» относится исключительно к полуреакциям, записанным в форме восстановления. Вычитая одну полуреакцию из другой, составляют уравнение полной окислительно-восстановительной реакции. Разность стандартных потенциалов находят, не изменяя знаков потенциалов, приведенных в таблицах, если последние составлены в соответствии с соглашением о знаках электродных потенциалов.
ПРИМЕР 1. Определите, в каком направлении пойдет реакция между железом(III) и иодидом калия?
Решение. Записываем уравнения соответствующих полуреакций и находим по таблицам значения стандартных потенциалов:
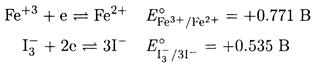
Записываем полную окислительно-восстановительную реакцию, вычитая второе уравнение из первого:
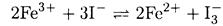
Разность потенциалов составляет
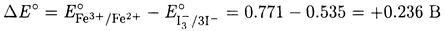
Положительная разность потенциалов указывает на протекание реакции в направлении окисления иодид-иона железом(III). К тому же выводу приходим, вычитая первую полуреакцию из второй, поскольку в этом случае разность потенциалов будет отрицательной.
Положительная разность потенциалов указывает на протекание реакции в направлении окисления иодид-иона железом (III).К тому же выводу приходим, вычитая первую полуреакцию из второй, поскольку в этом случае разность потенциалов будет отрицательной.
Глубина протекания реакции определяется константой равновесия. Реакцию окисления – восстановления
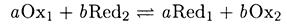
можно представить в виде двух полуреакций
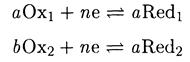
Запишем для каждой полуреакции уравнение Нернста
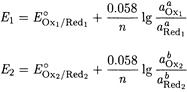
При равновесии E1 - E2, поэтому
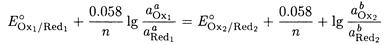
После преобразования получаем:
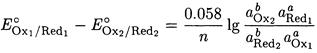
Под знаком логарифма стоит выражение для константы равновесия реакции окисления - восстановления, поэтому
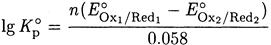 (5-1)
(5-1)
Здесь п - общее число электронов, участвующих в реакции окисления -восстановления.
ПРИМЕР 2. Рассчитайте термодинамическую константу равновесия реакции между железом (III) и иодидом калия.
Решение. Величины стандартных потенциалов обеих полуреакций даны в предыдущем примере. Подставляем их в формулу (5-1):
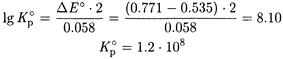
ПРИМЕР 3. Рассчитайте равновесные концентрации железа(III), железа(II), олова(II) и олова(IV) в растворе после установления равновесия реакции между 0.1 М раствором FeCl3 и 0.1 М раствором SnCl2, приняв ионную силу равной нулю.
Решение. Рассчитываем константу равновесия реакции
2Fe(III) + Sn(II) ↔ 2Fe(II) + Sn(IV)
из величин стандартных потенциалов полу реакций:
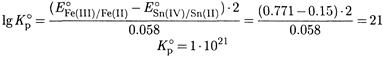
Большая величина константы позволяет считать, что реакция прошла практически полностью. Судя по стехиометрии, в реакцию вступило 0.1 М железа(III) и 0.05 М олова(II). Поэтому равновесная концентрация железа(II)
равна исходной концентрации железа(III), концентрация олова(II) - избыточной концентрации хлорида олова(II), т.е. 0.05 М, а концентрация олова(IV) – концентрации олова(II). вступившего в реакцию: [Fe(II)] = 0.1 М;
[Sn(II)] - 0.05 М; [Sn(IV)] - 0.05 М.
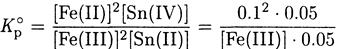
Отсюда
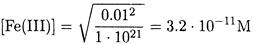
ПРИМЕР 4. Рассчитайте равновесную концентрацию железа(II) в растворе после установлении равновесия реакции между 0.01 М раствором перманганата калия и 0.05 М раствором сульфата железа(II) в 0.18 М соляной кислоте без учета ионной силы.
Решение. Рассчитаем константу равновесия реакции
МnО4- + 5Fe2+ + 8Н+ ↔ Mn2+ + 5Fe3+ + 4Н2О
используя табличные значения стандартных потенциалов
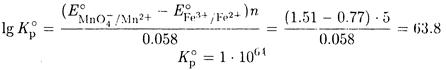
Константа равновесия велика, поэтому можно считать, что [Fe3+] = 0.05 М; [Мn2+] - 0.01 М; [H+] - 0.1 М.
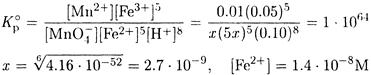
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 6742; Нарушение авторских прав?; Мы поможем в написании вашей работы!