
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергетика химических процессов и химическое сродство
Ниже приведенаметодика решения типовых задач (при решении задач этого раздела следует пользоваться данными таблицы 3).
Пример 1. Рассчитать стандартный тепловой эффект реакции
1/2Na2O(к) + 1/2H2O(ж) = NaOH(к).
Записать термохимическое уравнение реакции.
Решение. На основании следствия из закона Гесса можно записать
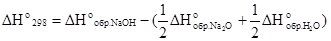 .
.
Подставив в это выражение значения стандартных энтальпий образования веществ с учетом их агрегатных состояний (табл. 3), получим
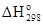 = - 426,60 –(- 215,30 - 142,92) = - 68,38 кДж/моль.
= - 426,60 –(- 215,30 - 142,92) = - 68,38 кДж/моль.
Термохимическое уравнение следует записать так:
1/2Na2O(к) + 1/2H2O(ж) = NaOH(к); 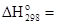 -68,38 кДж/моль.
-68,38 кДж/моль.
Пример 2. Реакция горения этилового спирта выражается термохимическим уравнением С2Н5ОН(ж) + 3О2(г) = 2СО2(г) +3Н2О(ж)); 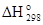 =?
=?
Вычислить тепловой эффект реакции, если известно, что молярная энтальпия парообразования С2Н5ОН(ж) равна +42,36 кДж и известны теплоты образования веществ, участвующих в этой реакции (табл. 3), а для этанола изменение энталь-пии образования составляет 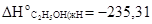 кДж/моль.
кДж/моль.
Решение. Для определения 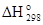 реакции необходимо знать теплоту образования этанола С2Н5ОН(ж):
реакции необходимо знать теплоту образования этанола С2Н5ОН(ж):
С2Н5ОН(ж) = С2Н5ОН(г); 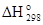 = +42,36 кДж/моль.
= +42,36 кДж/моль.
Запишем на основании следствия из закона Гесса:
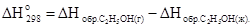 .
.
Подставив численные значения, получим 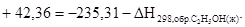 .
.
Отсюда легко рассчитать
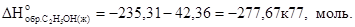
Таким образом, теперь имеются все данные для расчета теплового эффекта реакции:
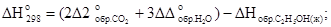
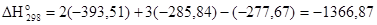 кДж.
кДж.
Пример 3. Не производя вычислений, определить знак изменения энтропии (ΔS) в следующих реакциях:
1) NН4NO3(к) = N2O (г) + 2Н2О (г);
2) 2Н2S + 3O2(г) = 2Н2О(ж) + 2SO2(г).
Решение. В первой реакции 1 моль вещества в кристаллическом состоянии образует 3 моля газов, следовательно, изменение энтропии ΔS >0. Во второй реакции уменьшается число молей газообразных веществ, следовательно, энтро-пия уменьшается, т. е. ΔS <0.
Пример 4. На основании стандартных теплот образования и абсолютных стандартных энтропий веществ (табл. 3) вычислите изменение энергии Гиббса реакции, протекающей по уравнению
СО(г) + Н2О(ж) = СО2(г) + Н2(г).
Решение. Известно, что энергия Гиббса является критерием возможности протекания химической реакции. Она рассчитывается по формуле
ΔGo = ΔHo – TΔSo,
где ΔHo –изменение энтальпии реакции, ΔSo- изменение энтропии реакции. Поскольку ΔHo и ΔSo– функциисостояния системы, то согласно следствию из закона Гесса имеем
ΔHo= 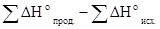 ; ΔSo=
; ΔSo= 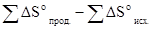 .
.
Отсюда
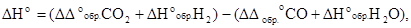
т.е.
ΔНо = (-393,51+0) - (-110,52 - 285,84),=+2,85 кДж/моль.
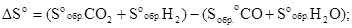
ΔSo=(213,65+130,59)-(197,91+69,94)= +76,39 Дж/моль·град или 0,07639 кДж/моль-град.
Тогда энергия Гиббса
ΔGo = +2,85 - 298(0,07639) = -19,91 кДж/моль.
Поскольку ΔGo< 0, то реакция возможна в прямом направлении.
Пример 5. Восстановление Fe2O3 водородом протекает по уравнению
Fe2O3(к) + 3H2(г) = 2Fe(к) + 3Н2О(г); ΔНо = +96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии ΔSo =+0,1387 кДж/моль-град? При какой температуре начнется восста-новление оксида железа(III)?
Решение. Вычисляем изменение энергии Гиббса реакции:
ΔGo = ΔHo – TΔSo = +96,61 - 298· 0,1387 = +55,28 кДж.
Так как ΔG° > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой ΔG° = 0:
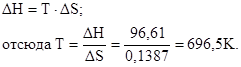
Следовательно, при температуре ≈696,5К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
|
|
Дата добавления: 2015-01-03; Просмотров: 836; Нарушение авторских прав?; Мы поможем в написании вашей работы!