
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика и равновесие
|
|
|
|
Скорость гомогенных и гетерогенных химических реакций зависит от природы реагирующих веществ, концентрации, температуры. Кроме того на ско-рость химических реакций существенное влияние оказывает физическое состо-яние реагентов и присутствие катализатора.
Скоростью гомогенной (гетерогенной) реакции называется количество вещества, вступающего или образующегося в процессе реакции за единицу времени в единице объема (на единице поверхности или на единицу массы или объема твердой фазы). Скорость реакции v обычно характеризуют изменением концентрации с какого-либо из исходных или конечных продуктов реакции в единицу времени τ, моль/см3•мин:

 .
.
Мгновенная скорость гомогенной реакции  . Если речь идет об убыли концентрации исходного вещества (с 2 – с 1) в интервале времени (τ2 – τ1), то (с 2 – с 1)<0. Скорость есть величина положительная, и в этом случае она берется со знаком минус. Если исходить из концентрации конечного продукта, то (с 2 – с 1)>0 и знак скорости положительный.
. Если речь идет об убыли концентрации исходного вещества (с 2 – с 1) в интервале времени (τ2 – τ1), то (с 2 – с 1)<0. Скорость есть величина положительная, и в этом случае она берется со знаком минус. Если исходить из концентрации конечного продукта, то (с 2 – с 1)>0 и знак скорости положительный.
Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Следовательно, в общем виде для реакции, идущей по уравнению
аA + bB = cC + dD,
кинетическое уравнение этого закона имеет вид
V = k[A]a ∙[B]b.
При расчете скорости реакции в зависимости от температуры можно пользоваться формулой (правило Вант-Гоффа)
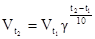 ,
,
где Vt2и Vt1 - скорости реакций при соответствующих температурах; γ- температурный коэффициент реакции, т. е. число, характеризующее увеличение скорости реакции при нагревании системы на 10°. Для большинства реакций при обычных условиях γ принимает значения от 2 до 4.
Не все столкновения молекул ведут к их взаимодействию. Чтобы произо-шла реакция, сталкивающиеся молекулы должны обладать энергией, превыша-ющей среднее значение энергии всех молекул. Такие молекулы называют активными. Энергию, необходимую для активирования молекул, называют энергией активации данной реакции. Энергия активации выражается в кДж/моль Чем больше энергия активации, тем меньше активных молекул при данной температуре и тем медленнее идет реакция.
От энергии активации зависит также температурный коэффициент ско-рости реакции  . Значения его 2, 3, 4 при обычных температурах соответс-твуют энергии активации 60, 90 и 120 кДж/моль. С повышением температуры увеличивается число результативных столкновений молекул и уменьшается энергия активации.
. Значения его 2, 3, 4 при обычных температурах соответс-твуют энергии активации 60, 90 и 120 кДж/моль. С повышением температуры увеличивается число результативных столкновений молекул и уменьшается энергия активации.
Выполнение неравенства ΔGo <0 не является гарантией фактического течения процесса в данных условиях, и этого не достаточно для оценки кинети-ческих возможностей реакции. Часто для осуществления процесса необходим катализатор, который снимает кинетический «тормоз», и тогда проявляется термодинамическая природа реагирующих веществ.
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе 2SO2(г) + O2(г)  2SOз(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
2SOз(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение. Согласно закону действия масс, выражения скорости прямой и обратной реакции до изменения объема имеют вид

 ,
,
где  и
и  константы скорости соответственно прямой и обратной реакции.
константы скорости соответственно прямой и обратной реакции.
После уменьшения объема гомогенной системы в три раза концентрация каж-дого из реагирующих веществ увеличится в три раза, тогда: [3SO2], [3О2] и [3SOз]. При новых концентрациях скорости прямой и обратной реакции следующие
 ;
;
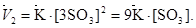
Отсюда

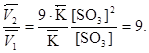
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в 9 раз. Равновесие системы сместилось в сторону образования оксида серы(VI).
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70°С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле
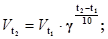
Отсюда имеем

Следовательно, скорость реакции  , протекающей при температуре 70оС, увели-чилась, по сравнению со скоростью реакции
, протекающей при температуре 70оС, увели-чилась, по сравнению со скоростью реакции  , протекающей при температуре 30оС, в 16 раз.
, протекающей при температуре 30оС, в 16 раз.
Пример 3. Обратимая эндотермическая реакция разложения хлорида фосфора (V) протекает по уравнению
PCl5(г) = РСl3(г) + Сl2(г); ΔНо = +92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РС15?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: если на систему в состоянии истинного равновесия воздействовать извне, изменяя термодинамические параметры, то равновесие сместится в таком направлении, которое ослабит эффект приложенного внешнего давления. Таким образом, при изменении температуры, давления и концентрации в рассматриваемой системе наблюдается следующее:
а) так как реакция разложения РС15 эндотермическая (ΔНо >0), то для сме-щения равновесия в сторону прямой реакции нужно повысить температуру;
б) так как в данной системе разложение РС15 ведет к увеличению объема, (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление;
в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5, так и уменьшением концентрации РС13 или Сl2.
Пример 4. Напишите выражение для константы равновесия гомогенной системы
CO(г) + Н2О(г)  СО2(г) + Н2(г).
СО2(г) + Н2(г).
Решение. При наступлении химического равновесии скорости прямой и обратной реакций равны, вследствие этого отношение констант этих скоростей есть величина постоянная. Она называется константой равновесия данной систе-мы:
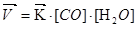 ;
;

Отсюда константа равновесия
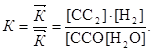
142. Как повлияет повышение давления при неизменной температуре на равновесие следующих систем:
а) 2HBr  H2 + Br2; ΔНо = +72,45 кДж;
H2 + Br2; ΔНо = +72,45 кДж;
б) 2СО + О2  2СО2; ΔНо = -566,49 кДж;
2СО2; ΔНо = -566,49 кДж;
в) N2 + О2  2NО; ΔНо = +181,01 кДж.
2NО; ΔНо = +181,01 кДж.
В какую сторону сместятся равновесия а) при повышении температуры и б) при понижении давления? Почему?
143. При 1000оС константа равновесия реакции
FeO + CO  Fe + CO2
Fe + CO2
равна К = 0,5.
Каковы равновесные концентрации СО и диоксида углерода, если начальные концентрации этих веществ составляли [CO] = 0,05 моль/л, [CO2] = 0,01 моль/л?
144. Напишите выражение скорости реакции, протекающей между следую-щими простыми веществами: а) азотом и кислородом; б) водородом и хлором;
в) оксидом азота (II) и кислородом.
145. Напишите выражение скорости химической реакции, протекающей в гомогенной системе по уравнению 3А + 2В = А3В2, и определить, во сколько раз увеличится скорость этой реакции, если: а) концентрация [A] увеличится в два раза; б) концентрация [В] увеличится в три раза; в) концентрация обоих веществ увеличится в два раза.
146. Во сколько раз следует увеличить давление, чтобы скорость образования диоксида азота по реакции 2NO + O2 = 2NO2 возросла в 1000 раз? Ответ под-твердите соответствующими расчетами.
147. Вычислите константу равновесия для гомогенной системы
СО(г)+Н2О(г)= СО2(г)+Н2(г),
если известны равновесные концентрации реагирующих веществ (моль/л):
[СО] =0,004, [Н2О] = 0,064, [СO2] = 0,016, [Н2] = 0,016.
148. На сколько градусов следует повысить температуру системы, чтобы ско-рость протекающей в ней реакции возросла в 30 раз? Температурный коэффициент скорости реакции γ =2,5.
149. При повышении температуры на 50°С скорость реакции возросла в 1200 раз. Вычислите значение температурного коэффициента скорости γ.
150. Как изменится скорость реакции, протекающей в газовой фазе, при повы-шении температуры на 60°С, если температурный коэффициент скорости данной реакции равен γ =3,5?
151. Почему при изменении давления смещается равновесие системы
N2+ЗН2 = 2NН3
и не смещается равновесие в системе
N2+О2 = 2NО?
Напишите выражения для констант равновесия каждой из данных систем.
152. При некоторой температуре в системе
2NO2(г)  2NO(г) + O2(г)
2NO(г) + O2(г)
константа химического равновесия составляет К = 12,8, а равновесная концен-трация кислорода [O2] = 0,2 моль/л. Определите начальную концентрацию диок-сида азота.
153. При некоторой температуре в системе
2SOз(г)  2SO2(г) + О2(г)
2SO2(г) + О2(г)
равновесные концентрации веществ равны соответственно 0,04, 0,12 и 0,06 моль/л. Рассчитайте константу химического равновесия этой реакции. Что можно сказать по ее величине о положении химического равновесия в данной системе?
154. Вычислите равновесные концентрации водорода и йода в реакции
Н2 + J2  2HJ,
2HJ,
если их начальные концентрации составляли по 0,03 моль/л, а равновесная кон-центрация йодоводорода [HJ] = 0,04 моль/л. Вычислите константу химического равновесия.
155. Почему при изменении давления смещается равновесие системы
2SO2(г) + O2(г)  2SOз(г)
2SOз(г)
и не смещается равновесие системы
N2+О2  2NO?
2NO?
Напишите выражение для константы равновесия каждой из данных систем.
156. В каком направлении произойдет смещение равновесия системы
Н2 +S  H2S,
H2S,
если: а) увеличить концентрацию водорода; б) понизить концентрацию серово-дорода? Cоставьте выражения скорости прямой и обратной реакций.
157. В каком направлении произойдет смещение равновесия системы
ЗFе+4Н2O  4Н2 + Fe3O4,
4Н2 + Fe3O4,
если: а) увеличить концентрацию водорода; б) уменьшить концентрацию паров воды?
158. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80°С. Температурный коэффициент скорости реакции равен трем.
159. Рассчитайте, как изменятся скорости прямой и обратной реакций в равновесной системе
2C2H6(г) + 7O2(г)  4CO2(г) + 6H2O(г),
4CO2(г) + 6H2O(г),
если давление увеличить в 3 раза? В каком направлении сместится равновесие?
160. На сколько градусов нужно повысить температуру, чтобы скорость реак-ции возросла в 90 раз? Температурный коэффициент скорости реакции равен 2,7.
161. Рассчитайте равновесную концентрацию диоксида углерода в системе
2C2H6(г) + 7O2(г)  4CO2(г) + 6H2O(г),
4CO2(г) + 6H2O(г),
если известны равновесные концентрации, моль/л: [C2H6] = 0,22; [O2] = 1,34; [H2O] = 0,57, а константа химического равновесия составляет К = 0,11.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 1115; Нарушение авторских прав?; Мы поможем в написании вашей работы!