
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение массовой доли вещества в растворе
|
|
|
|
РАСТВОРЫ. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Раствором называется однородная система переменного состава, состоящая из двух или более компонентов.
Всякий раствор состоит из растворенных веществ и растворителя.
Растворитель – это компонент раствора, находящийся в том же агрегатном состоянии, что и раствор.
В случае же растворов, образующихся при смешивании газа с газом, жидкости с жидкостью, твердого вещества с твердым, растворителем считается тот компонент, количество которого в растворе преобладает. Растворы бывают га-зовыми, жидкими и твердыми.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным, а растворы, близкие к состоянию насыщения, называются концентрированными.
В большинстве случаев употребляют растворы ненасыщенные, т.е. с мень-шей концентрацией растворенного вещества, чем в насыщенном растворе.
Концентрация раствора – это содержание растворенного вещества в опреде-ленной массе или определенном объеме раствора или растворителя.
Массовая доля – это отношение массы компонента m B к массе раствора m:
w В = m B /m. (1)
Массовая доля выражается в долях единицы или процентах (5%-ный раствор серной кислоты содержит 5 г Н2SO4 в 100 граммах раствора или в 95 г раствори-теля - воды).
Пример 1. В 220 г воды растворили 30 г хлорида натрия. Вычислите массовую долю хлорида натрия в растворе.
Решение. Масса раствора m складывается из массы растворителя m H2O и массы растворенного вещества m NaCl:
m = m H2O + m NaCl; m = 220 + 30 =250 г.
По уравнению (1) находим
w NaCl = m NaCl / m; w NaCl = 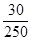 = 0,12 или 12 %.
= 0,12 или 12 %.
Пример 2. Определите массу хлорида натрия, который надо растворить в воде, чтобы получить 100 мл раствора с массовой долей NaCl 20 %. Плотность раствора r = 1,5 г/мл.
Решение. Масса раствора, который необходимо приготовить,
m = V× r,
где V – объем раствора;
m = 100×1,15 = 115 г.
Из уравнения (1) следует
m NaCl = m × w NaCl; m NaCl = 115×0,2 = 23 г.
|
|
|
Дата добавления: 2015-01-03; Просмотров: 745; Нарушение авторских прав?; Мы поможем в написании вашей работы!