
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Смешивание растворов разных концентраций
И объемами растворов реагирующих веществ
Отношение между эквивалентными концентрациями
Молярная масса эквивалента серной кислоты
ЭмН2SO4 = 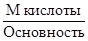 =
= 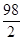 = 49 г/моль.
= 49 г/моль.
Следовательно, Сн = 165/49 =3,37 моль/л.
Пример 10. Для нейтрализации 50 мл раствора серной кислоты израсхо-довано 25 мл 0,4 н раствора щелочи. Определите нормальную концентрацию рас-твора серной кислоты.
Решение. В реакции нейтрализации в точке эквивалентности соблюдается равенство: Сн.кислоты∙Vкислоты= Сн.щелочи∙Vщелочи, что следует из закона эквивалентов. Тогда имеем:
 . Отсюда
. Отсюда 
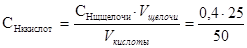 = 0,2н
= 0,2н
(т.е. 0,2 эквивалента в 1 л раствора).
Пример 11. Сколько граммов 30%-ного раствора гидроксида калия надо прибавить к 200 г 90%-ного раствора, чтобы получить 50%-ный раствор гидроксида калия?
Решение. Задачи такого плана легко решаются с помощью диагональной схемы («правила креста»). Ее строят следующим образом. В точке пересечения двух прямых обозначают концентрацию смеси, у концов этих прямых по одну сторону от точки пересечения указывают концентрации составных частей смеси, а по другую разности концентраций смеси и ее составных частей. Диагональная схема для данной задачи имеет вид:

 30 40
30 40
 |  |
90 20
Из этой схемы следует, что для приготовления 50%-ного раствора гидрок-сида калия требуется взять 40 г 30%-ного раствора (более разбавленного) и 20 г 90%-ного раствора гидроксида калия.
Если обозначить массу 30%-ного раствора КОН через Х, то  , откуда Х = 400 г 30%-ного раствора КОН.
, откуда Х = 400 г 30%-ного раствора КОН.
162. В 200 мл воды растворили 40 г бромида калия. Какова массовая доля соли в данном растворе? (rН2О = 1 г/мл).
163. Определите массовую долю (в %) хлорида натрия в растворе, содержащем 80 г соли и 500 г раствора.
164. Определите массу хлорида калия, который надо растворить в воде, чтобы получить 100 мл раствора с массовой долей КCl 20 %. Плотность раствора r = 1,15 г/мл.
165. К 50 мл 96%-ного раствора серной кислоты плотностью r = 1,84 г/мл прибавили 100 мл Н2О, получился раствор с плотностью r=1,2 г/мл. Какова массовая доля в % полученного раствора?
166. Какое количество хлорида аммония необходимо для приготовления 500 мл 0,2М NH4Cl? Рассчитайте эквивалентную концентрацию и титр этого раствора.
167. Титр раствора хлорида кальция равен 0,0222 г/мл. Рассчитайте молярную и нормальную концентрации этого раствора.
168. Рассчитайте нормальность концентрированной соляной кислоты (плотность 1,18 г/мл), содержащей 36,5 % НCl.
169. Определите молярность для 6%-ного раствора Na2S с плотностью 1,067 г/мл.
170. Определите молярность, нормальность, моляльность 10%-ного раствора серной кислоты, если плотность этого раствора r = 1,066 г/мл.
171. Сколько миллилитров 96%-ной серной кислоты, плотность которой 1,84 г/мл, нужно взять для приготовления 1 л 0,5Н раствора?
172. В 1 кг воды растворено 666 г КОН, плотность раствора равна 1,359 г/мл. Найдите массовую долю КОН в растворе, молярность, моляльность.
173. Сколько литров 30%-ного раствора НNO3 (r = 1180 кг/м3) требуется для приготовления 20 л 0,5М раствора этой кислоты?
174. Определите нормальность, моляльность и титр 0,8М сульфата железа (III), если плотность раствора 1000 кг/м3.
175. Какова массовая доля в % раствора соляной кислоты, полученного сливанием 100 мл 28%-ного раствора соляной кислоты (r = 1,18 г/мл) и 90 мл 1,5М раствора (r = 1,03 г/мл)?
176. К 500 мл раствора соляной кислоты (r = 1,1 г/мл) прибавили 2,5 л воды, и раствор стал 4%-ный. Вычислите концентрацию исходного раствора.
177. Сколько граммов сульфата натрия нужно взять для приготовления 10 л 8%-ного раствора (r =1,075 г/см3)? Рассчитайте молярную концентрацию этого раствора.
178. Для нейтрализации 15 мл 0,2Н раствора кислоты потребовалось 30 мл раствора щелочи. Определите нормальность щелочи.
179. Для нейтрализации 30 мл 0,1Н раствора щелочи потребовалось 12 мл раствора кислоты. Определите нормальность кислоты.
180. Сколько граммов 20%-ного раствора КОН надо прибавить к 250 г 90%-ного раствора, чтобы получить 50%-ный раствор КОН?
181. В каком отношении по массе и по объему нужно смешать 54%-ный раствор азотной кислоты (r = 1,33 г/мл) с 14%-ным раствором (r = 1,08 г/мл), чтобы получить 20%-ный раствор?
|
|
Дата добавления: 2015-01-03; Просмотров: 1973; Нарушение авторских прав?; Мы поможем в написании вашей работы!