
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородный показатель
|
|
|
|
Вода – очень слабый электролит. Уравнение диссоциации воды
H2O ⇄ H+ + OH-
Константа диссоциации этого процесса определена экспериментально:
Kд =  = 1,8×10-16. (1)
= 1,8×10-16. (1)
Степень диссоциации воды очень мала, поэтому концентрация недис-социированных молекул воды практически равна общей концентрации воды. Концентрацию молекул воды можно рассчитать, разделив массу 1 л воды на массу ее моля:
[H2O] = 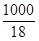 = 55,5 моль/л.
= 55,5 моль/л.
Подставляя в уравнение (1) величины Kд и [H2O], будем иметь для стандартных условий
[H+]×[OH-] = 10-14.
Произведение концентратов ионов водорода и гидроксид-ионов в воде (ионное произведение воды), обозначаемое Kw, при данных условиях является величиной постоянной:
Kw = [H+]×[OH-] = 10-14.
В чистой воде [H+] = [OH-] = 10-7 моль/л. Если, например, к чистой воде добавить столько кислоты, чтобы концентрация ионов H+ повысилась до 10-3 моль/л, то концентрация гидроксид-ионов понизится и произведение [H+]×[OH-] останется равным 10-14. Следовательно, в этом растворе концентрация гидроксид-ионов будет следующей:
[OH-] = 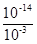 = 10-11 моль/л.
= 10-11 моль/л.
И, наоборот, если добавить к воде щелочь и повысить концентрацию гидроксид-ионов, например до 10-5 моль/л, то концентрация ионов водорода
[H+] =  = 10-9 моль/л.
= 10-9 моль/л.
Таким образом, чтобы охарактеризовать реакцию среды любого водного раствора, достаточно указать лишь концентрацию ионов H+ (или OH-). На практике за такой показатель была принята концентрация ионов H+. В нейтральном растворе [H+] = 10-7 моль/л, в кислом [H+] > 10-7 (например 10-4, 10-6), в щелочном [H+] < 10-7 (например 10-8, 10-9).
Для удобства концентрацию H+ характеризуют водородным показателем рН:
рН = -lg[H+].
В нейтральном растворе рН = 7, в кислотном рН < 7, в щелочном рН > 7.
Задача 1. Концентрация гидроксид-ионов равна 0,00001 моль/л. Опреде-лить концентрацию ионов водорода и рН раствора.
Решение. [OH-] = 0,00001 = 1,0×1,0-5 моль/л. Используя выражение ионного произведения воды, рассчитаем концентрацию ионов водорода:
[H+] =  = 10-9 моль/л.
= 10-9 моль/л.
рН представляет собой десятичный логарифм концентрации водородных ионов в растворе, взятый с обратным знаком: рН = -lg[H+]. Подставим значение [H+] = 10-9 моль/л в формулу и определим водородный показатель раствора: рН = -lg10-9 = 9.
Задача 2. Приготовили 0,01М раствор NaOH. Чему равна [OH-]? Вычислите [H+].
Решение.
1. Если считать, что NaOH диссоциирует на 100 %, то [OH-] = 10-2 моль/л.
2. [H+]×[OH-] = 10-14, откуда [H+] =  = 10-12 моль/л.
= 10-12 моль/л.
Задача 3. Определить [H+] для раствора с рН = 5. Какой это раствор - кис-лый или щелочной?
Решение. Поскольку рН = -lg[H+] и известно, что рН = 5, то [H+] = 10-5 моль/л, раствор кислый, т.е. рН < 7.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 522; Нарушение авторских прав?; Мы поможем в написании вашей работы!