
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамические константы некоторых веществ
|
|
|
|
Таблица 3
| Вещество |  , кДж/моль , кДж/моль
|  ,кДж/моль ,кДж/моль
| 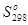 , Дж/(моль•К) , Дж/(моль•К)
| |
| Al2O3(к) | -1676,8 | -1583,3 | 50,95 | |
| ВаО (к) | -553,90 | -525, | 70,5 | |
| ВаСО3 (к) | -1217,10 | -1137,2 | 113,0 | |
| ВеО (к) | -598,70 | -581,60 | 14,10 | |
| ВеСО3 (к) | -981,57 | -944,75 | 199,40 | |
| С (алмаз) | 1,828 | 2,834 | 2,37 | |
| С (графит) | 5,74 | |||
| Cl2(г) | 222,9 | |||
| Cl2O7(г) | 286,6 | 399,1 | - | |
| COCl2(г) | -220,3 | -266,9 | 283,9 | |
| СО (г) | -110,5 | -137,27 | 197,4 | |
| СО2 (г) | -393,51 | -394,38 | 213,6 | |
| С2Н2 (г) | 226,75 | 209,20 | 200,80 | |
| С2Н4 (г) | 52,28 | 68,12 | 219,40 | |
| Окончание табл.3 | ||||

| ||||
| СН3ОН (ж) | -238,70 | -166,31 | 126,7 | |
| С2H5OH(ж) | -227,6 | -174,77 | 160,7 | |
| СаО (к) | -635,10 | -604,20 | 39,70 | |
| Са(ОН)2 (к) | -986,20 | -896,76 | 83,40 | |
| СаСО3 (к) | -1206,00 | -1128,80 | 92,90 | |
| Сa3N2(к) | -431,8 | -368,6 | 105,0 | |
| FeO (к) | -263,68 | -244,35 | 58,79 | |
| Fe2O3 (к) | -821,32 | -740,99 | 89,96 | |
| Fe(OH)2 (к) | -562,10 | -480,10 | 88,00 | |
| Fe(OH)3 (к) | -824,25 | -694,54 | 96,23 | |
| Fe3O4(к) | -1117,9 | -1014,8 | 146,3 | |
| Н2О (г) | -241,84 | -228,80 | 188,74 | |
| Н2О (ж) | -285,84 | -237,50 | 69,96 | |
| HCl (г) | -92,30 | -95,27 | 186,70 | |
| НСl (ж) | -167,50 | -131,2 | 55,20 | |
| Mg(к) | ||||
| MgO(к) | -601,8 | -569,6 | 26,9 | |
| MgCl2(к) | -641,1 | -591,6 | 89,8 | |
| NH3 (г) | -46,19 | -16,64 | 192,5 | |
| NH4Cl (к) | -315,39 | -343,64 | 94,56 | |
| NH4NO3(к) | -365,4 | -183,9 | 151,1 | |
| NO (г) | 90,37 | 86,69 | 210,62 | |
| NO2(г) | 51,5 | 240,2 | ||
| N2O(г) | 82,1 | 104,2 | 220,0 | |
| NaCl(г) | -410,0 | -384,0 | 72,36 | |
| Na2O(к) | -430,6 | -376,6 | 71,1 | |
| NaOH(К) | -426,6 | -377,0 | 64,18 | |
| Р2О5 (к) | -1492,00 | -1348,8 | 114,50 | |
| Р4О10(к) | -2984,0 | -2697,8 | 228,8 | |
| Ti(к) | 30,6 | |||
| TiCl3(к) | -721,0 | -654,1 | 139,7 | |
| N2 (г) | 191,50 | |||
| Н2 (г) | 130,70 | |||
| О2 | 205,03 | |||
| Cl2 | 222,9 | |||
| Fe | 27,2 | |||
| ZnS(к) | -201,00 | -198,32 | 57,7 | |
| ZnO(к) | -349,0 | -318,19 | 43,5 | |
| H2S(г) | -20,15 | -33,02 | 205,64 | |
| SO2(г) | -296,9 | -300,37 | 248,10 | |
| SO3(г) | -395,2 | -370,37 | 256,23 | |
| CS2(г) | 115,30 | 65,10 | 237,80 | |
| СS2(ж) | 87,80 | 63,60 | 151,00 | |
| HNO3(Ж) | -173,0 | -79,91 | 153,16 | |
101. Рассчитайте изменение энтальпии реакции получения рения по реакции
2NH4ReO4(к) + 4H2(г) = 2Re(к) + N2(г) + 8H2O(г)
если энтальпии образования ∆Но NH4ReO4 и воды соответственно равны -967,15 и -242,00 кДж/моль. Экзо- или эндотермическим является этот процесс?
102. Составьте уравнения реакций оксидов натрия, магния и алюминия с водой. Определите изменения ∆Go298 указанных реакций из расчета на 1 моль воды. Проанализируйте результаты расчетов и определите, как изменяются активность и основные свойства оксидов элементов III периода?
103. Вычислите ∆Go298 реакций взаимодействия Р4О10, оксида серы(VI) и оксида хлора(VII) с водой в расчете на 1 моль воды. Как изменяется реакционная способность в ряду указанных оксидов?
104. Известно, что при нагревании нитрат аммония может распадаться по схеме
NH4NO3(к) = N2(г) + 1/2O2(г) + 2H2O(г).
Можно ли считать нитрат аммония устойчивым соединением? Ответ подтвердите расчетом энергии Гиббса, используя стандартные энтальпии и энтропии образования участвующих в данной реакции веществ.
105. Возможно ли использование металлического магния для получения титана восстановлением хлорида титана(III) по схеме:
TiCl3(ж) + 2Mg (к) = 2Ti(к) + 2MgCl2(к).
Ответ подтвердите расчетом энергии Гиббса, используя стандартные энталь-пии и энтропии образования участвующих в данной реакции веществ.
106. Разложение нитрата аммония возможно по двум схемам:
1) NH4NO3(к) = N2O(г) + 2H2O(г)
2) NH4NO3(к) = N2(г) + 1/2O2(г) + 2H2O(г).
Какая из приведенных реакций наиболее вероятна и какая из них протекает с большим выделением тепла? Ответ подтвердите расчетом энергии Гиббса, используя стандартные энтальпии и энтропии образования участвующих веществ.
107. Вычислите ΔGo для реакции
Fe(OH)2(к) + О2(г) + Н2О(ж) → Fe(OH)3(к).
По результатам расчета сделайте вывод, какая степень окисления более характерна для железа.
108. Одним из способов промышленного получения водорода является взаимодействие метана с водяным паром:
СН4(г) + Н2О(г) = СО(г) + 3Н2(г)
Рассчитайте  и
и  этой реакции и решите, будет ли она протекать при стандартных условиях.
этой реакции и решите, будет ли она протекать при стандартных условиях.
109. При взаимодействии газообразных метана и сероводорода образуется сероуглерод CS2(г) и водород. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект  .
.
110. Можно ли получить аммиак по реакции
NH4Cl(к) + NaOH(к) = NaCl(к) + H2O(г) + NH3(г)?
Ответ поясните соответствующими расчетами изменения энтальпии, энтропии реакции и энергии Гиббса.
111. Уменьшается или увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислите изменение энтропии ΔSo для каждого превращения.
112. Прямая или обратная реакция будет протекать при стандартных условиях в системе
2NО(г) + O2(г) = 2NО2(г)
Ответ мотивируйте, вычислив энергию Гиббса прямой реакции.
113. Восстановление Fe3O4 оксидом углерода идет по уравнению
Fe3O4 + СО(г) = 3FеО(к) + СO2(г)
Вычислите изменение энергии Гиббса и сделайте вывод о возможности само-произвольного протекания этой реакции при стандартных условиях. Чему равно изменение энтропии ΔSо в этом процессе?
114. Исходя из значения стандартных теплот образования и абсолютных стан-дартных энтропий соответствующих веществ, вычислите ΔGo реакции, протека-ющей в смеси аммиака с хлороводородом и приводящей к образованию твердого хлорида аммония. Приведите термохимическое уравнение указанного процесса. Может ли эта реакция при стандартных условиях идти самопроизвольно?
115. Чем можно объяснить, что при стандартных условиях невозможна экзо-термическая реакция, протекающая по уравнению
Н2(г) + СО2(г) = СО (г) +Н2О(ж); ΔНo = -2,85 кДж.
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответс-твующих веществ, определите ΔGo этой реакции.
116. Реакция горения ацетилена протекает по уравнению
С2Н2(г) + 5/2О2(г) = 2СО2(г) +Н2О(ж).
Вычислите ΔGo, ΔSo и объясните уменьшение энтропии в результате этой реакции.
117. Какие из карбонатов - ВеСО3, СаСО3 или ВаСО3 – можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив изменение энергии Гиббса всех реакций.
118. Устойчив ли нитрид кальция при стандартных условиях в парах воды:
Сa3N2(к) + 6H2O(ж) = 2NH3(г) + 3Ca(OH)2(к)?
Ответ подтвердите расчетами изменения энергии Гиббса этой реакции.
119. Рассчитайте температуру, при которой начинается реакция разложения азотной кислоты, протекающая по схеме
4HNO3(ж) = 2H2O(г) + 4NО2(г) + O2(г).
Для расчета используйте изменение энтальпии и энтропии образования веществ, приведенные в табл.3.
120. Возможно ли окисление кальция в атмосфере углекислого газа по реакции
СО2(г) + 2Са(к) = СаО(к) +С (графит)?
Ответ подтвердите соответствующими расчетами, учитывая, что реакция про-текает в стандартных условиях.
121. Газообразный этиловый спирт С2Н5ОН можно получить при взаимодей-ствии этилена С2Н2(г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
122. При взаимодействии газообразных сероводорода и оксида углерода (IV) образуются пары воды и сероуглерод СS2(г). Напишите термохимическое уравне-ние этой реакции, вычислив ее тепловой эффект.
123. Напишите термохимическое уравнение реакции между оксидом углеро-да(II) и водородом, в результате которой образуются метан и пары воды. Сколько теплоты выделится при этой реакции?
124. Тепловой эффект реакции сгорания моля жидкого бензола с образовани-ем паров воды и оксида углерода (IV) составляет ∆Но = -3135,58 кДж. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования жидкого бензола С6Н6(ж).
125. Исходя из теплот образования воды и водяного пара вычислите теплоту испарения воды.
126. При взаимодействии трех молей N2О(г) с аммиаком МН3(г) образуются азот и пары воды. Тепловой эффект реакции равен ∆Но = -877,76 кДж. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования окси-да азота(I).
127. Исходя из реакции
МnО2 + 2С = Мn + 2СО; ∆Но = 298,96 кДж,
вычислите стандартную энтальпию образования диоксида марганца.
128. Реакция горения метилового спирта выражается термохимическим уравнением
СН3ОН(ж) + 3/2O2(г) = СО2(г) + 2Н2О(ж); ∆Но = -726,64 кДж.
Рассчитайте стандартную энтальпию образования метанола.
129. На основании стандартных теплот образования и абсолютных стандартных
энтропий соответствующих веществ вычислите изменение энергии Гиббса ΔG° реак-
ции, протекающей по уравнению
С2Н4(г) + ЗО2(г) = 2СО2(г) + 2Н2О(ж).
Возможна ли эта реакция при стандартных условиях?
130. На основании стандартных теплот образования и абсолютных стандарт-ных энтропий соответствующих веществ вычислите ΔG° реакции, протекающей по уравнению
4HCl(г) + О2(г) = 2Сl2(г) + 2Н2О(ж)
Возможна ли эта реакция при стандартных условиях?
131. Определите ΔG° реакции, протекающей по уравнению
4NH3(г) + 5O2(г) = 4NО(г) + 6Н2O(г)
Вычисления сделайте на основании стандартных энтальпий образования и абсолютных стандартных энтропий соответствующих веществ. Возможна ли эта реакция при стандартных условиях?
132. На основании стандартных теплот образования и абсолютных стандарт-ных энтропий соответствующих веществ вычислите изменение энергии Гиббса реакции, протекающей по уравнению
СО2(г) + Н2О(ж) = СО(г) + Н2(г).
Возможна ли эта реакция при стандартных условиях?
133. Пользуясь значениями ΔG° образования отдельных соединений, вычислите изменение энергии Гиббса реакции
СОСl2(г) = СO(г) + Сl2(г)
и определите, возможно ли ее осуществление в стандартных условиях.
134. Пользуясь значениями ΔН° и S°, вычислить ΔG° реакции
C(графит)+O2 = СO2; ΔH° = -393,5 кДж
При каких условиях возможна данная реакция?
135. Определите, возможна ли при Т=2000К реакция
Fe2O3(к) + 3СО(г) = 2Fe(к) + 3СО2(г)?
Ответ подтвердите расчетом энергии Гиббса, используя данные табл.3.
136. Вычислите значения энергии Гиббса следующих реакций восста-новления оксида железа(II):
а) FeO(к) + 1/2C(графит) = Fe(к) + 1/2CO2(г);
б) FeO(к) + C(графит) = Fe(к) + CO(г);
в) FeO(к) + CО(г) = Fe(к) + CO2(г).
Протекание какой из этих реакций наиболее вероятно?
137. Не производя вычислений, дайте мотивированный ответ, для каких из перечисленных ниже процессов изменение энтропии является положительной величиной:
а) MgO(к) + H2(г) = Mg (к) + H2O(ж);
б) C(графит) + СО2(г) = 2CO(г);
в) СН3СООН(раствор)  СН3СОО- + Н+;
СН3СОО- + Н+;
г) 4HCl(г) + О2(г) = 2Cl2(г) + 2Н2О(г);
д) NH4NO3(к) = N2O(г) + 2Н2О(г).
138. Эндотермическая реакция взаимодействия метана с оксидом углерода (IV) протекает по уравнению
СН4(г) + СО2(г) = 2СО(г) + 2Н2(г); ΔНо = + 247,37 кДж.
Рассчитайте температуру начала этой реакции.
139. Определите, при какой температуре начинается реакция восстановления, протекающая по уравнению
Fе3O4(к) + СО(г) = ЗFеО(к) + СО2(г); ΔHo = + 34,55 кДж.
140. Дайте аргументированный ответ, в каком из следующих случаев реакция не осуществима при любых температурах: а) ΔНо >0, ΔSо>0; б) ΔНо >0, ΔSо < 0; в) ΔНо <0, ΔSо < 0; г) ΔНо<0, ΔSо>0.
141. Исходя из реакции
8Аl + 3Fe3О4 = 4A2O3 + 9Fе; ∆Но = -3353,7кДж
вычислите стандартную энтальпию образования смешанного оксида Fe3О4.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 2340; Нарушение авторских прав?; Мы поможем в написании вашей работы!