
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вычисления в титриметрическом анализе
|
|
|
|
ТИТРИМЕТРИЧЕСКИЙ (ОБЪЕМНЫЙ) АНАЛИЗ
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Количественный анализ изучает методы определения количества составных частей (элементов, ионов, молекул, радикалов, функциональных групп и т.д.) в анализируемом образце (веществе, сложном материале, минерале, горной породе).
Методы количественного анализа делятся на химические, физико-химические и физические. Отнесение метода к той или иной группе зависит от того, в какой мере количественное определение основано на использовании химических реакций, физико-химических или физических процессов.
Соответственно трем агрегатным состояниям материи - твердому, жидкому и газообразному - количественные измерения проводят путем определения массы (взвешивание) и путем определения объемов жидких и газообразных веществ.
К химическим методам относятся гравиметрический (весовой), титриметрический (объемный) и газовый анализ.
Физические и физико-химические методы включают оптические, электрохимические, масс-спектральный, хроматографический, радиометрический и др.
Титриметрическим анализом называют метод количественного химического анализа, который основан на точном измерении объема реактива известной концентрации, необходимого для реакции с данным количеством определяемого вещества.
Метод заключается в том, что к раствору определяемого вещества А постепенно прибавляют раствор реактива В известной концентрации. Добавление реактива В продолжается до того момента, пока его количество не станет эквивалентным количеству реагирующего с ним определяемого вещества А.
Количественные определения с помощью этого метода выполняются очень быстро. Момент окончания реакции, когда взаимодействующие вещества полностью прореагируют между собой, называется точкой эквивалентности. В этот момент количества прореагировавших веществ эквивалентны.
Титрование - это процесс постепенного приливания одного раствора к другому для определения концентрации одного из этих растворов.
Титрант (титрованный или рабочий раствор) - это раствор с точно известной концентрацией.
Концентрацию рабочих растворов определяют по стандартному веществу, которое должно удовлетворять следующим требованиям: быть устойчивым при хранении, как в твердом состоянии, так и в растворе, строго соответствовать определенной формуле, хорошо очищаться.
Для выражения концентрации растворов в этом методе анализа обычно используют молярную концентрацию эквивалента.
Молярная концентрация эквивалента (нормальность) - это количество вещества эквивалента, которое содержится в 1 литре раствора.
М олярная концентрация эквивалента обозначается СЭ (допускается N), и рассчитывается по формуле: СЭ= nэ/V, где nэ - количество вещества эквивалента, моль; V - объем раствора, л единица измерения концентрации - моль/л. Количество вещества эквивалента (nэ) того или иного вещества в заданном объеме равно: nэ = m/Mэ = Сэ·V, где m - масса вещества, г; MЭ - молярная масса эквивалента, г/моль,V - объем раствора, л.
Таким образом, при титровании в точке эквивалентности количество вещества эквивалента титрованного раствора равно количеству вещества эквивалента определяемого вещества - закон эквивалентов: nэ(A) = nэ(B) или
Сэ(А) · V(А) = Сэ(В) · V(В), отсюда 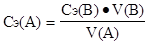
Кроме молярной концентрации эквивалента концентрацию выражают титром (Т). Титр - это количество граммов растворенного вещества, содержащегося в 1 мл раствора.
Титр и молярная концентрация эквивалента раствора связаны формулой:
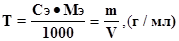
Титр по определяемому веществу - это количество граммов определяемого вещества, которое реагирует с 1 мл титранта.
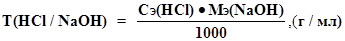
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 6373; Нарушение авторских прав?; Мы поможем в написании вашей работы!