
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приготовление и стандартизация раствора hcl
|
|
|
|
Лабораторная работа № 1
Титрование слабого основания сильной кислотой
Титрование слабой кислоты сильным основанием
Титрование сильной кислоты сильным основанием
Характеристики некоторых индикаторов
| Индикатор | Интервал перехода рН | Цвет индикатора в зависимости от величины рН раствора | ||
| Лакмус | 5 - 8 | красный рН < 5 | фиолетовый рТ = рН = 7 | синий рН > 8 |
| Фенолфта-леин | 8,2 - 10 | бесцветный рН < 8,2 | розовый рТ = рН = 9 | малиновый рН>10 |
| Метиловый оранжевый | 3,1 - 4,4 | красный рН < 3,1 | оранжевый рТ = рН = 4 | желтый рН > 4,4 |
Рассмотрим следующие случаи титрования.
HCl + NaOH ® NaCl + H2O
H+ + OH- ® H2O
В точке эквивалентности образуется соль сильной кислоты и сильного основания, которая не подвергается гидролизу. Реакция среды будет нейтральной (рН=7). В данном случае индикатором может служить лакмус.
CH3COOH + NaOH ® CH3COONa + H2O
CH3COOH + OH- ® CH3COO- + H2O
Образующаяся соль слабой кислоты и сильного основания в растворе подвергается гидролизу:
CH3COO- + HOH ® CH3COOH + OH-
Точка эквивалентности в этом случае будет находиться в щелочной среде, поэтому следует применять индикатор, меняющий окраску при рН>7, например, фенолфталеин.
NH4OH + HCl ® NH4Cl + H2O
NH4OH + H+ ® NH4+ + H2O
Образующаяся соль в растворе подвергается гидролизу:
NH4+ + HOH ® NH4OH + H+
Точка эквивалентности будет находиться в кислой среде, поэтому можно применять метилоранж.
Лабораторная работа состоит из двух частей:
1. Приготовление 250 мл 0,1 моль/л раствора соляной кислоты из концентрированного раствора кислоты.
2. Стандартизация раствора HCl или установление точной концентрации приготовленного раствора соляной кислоты методом титрования ее раствором щелочи, концентрация которой известна.
1. Приготовление 250 мл 0,1 моль/л раствора соляной кислоты
С помощью ареометра определите плотность выданного Вам концентрированного раствора соляной кислоты (допустим, что r = 1,179 г/мл).
По таблице плотности растворов (приложение табл. 3) найдите массовую долю кислоты в этом растворе (w = 36%). Рассчитайте какой объем 36% раствора HCl Вам нужно взять для приготовления 250 мл 0,1 моль/л раствора.
Молярная масса эквивалента HCl равна 36,46 г/моль, поэтому в 250 мл 0,1 моль/л раствора должно содержаться 0,912 г безводной HCl:
m (HCl) = MЭ · СЭ · V = 36,46 · 0,1 · 0,25 = 0,912 г
Масса 36% раствора HCl, содержащая это количество кислоты, равна:
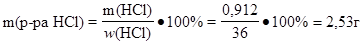
Объем исходного раствора кислоты можно найти по формуле:
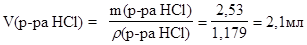
Отмерьте маленьким мерным цилиндром рассчитанный объем (» 2,0 мл)36% раствора соляной кислоты и перелейте в большой цилиндр. Доведите объем раствора до 250 мл дистиллированной водой, слейте его в склянку на 250 мл и перемешайте.
|
|
|
Дата добавления: 2015-01-03; Просмотров: 3226; Нарушение авторских прав?; Мы поможем в написании вашей работы!