
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Иммунокомпетентные клетки
|
|
|
|
К ним относят Т- и B–лимфоциты, NK–клетки, антигенпредставляющие клетки. T–лимфоциты развиваются в тимусе из клеток–предшественниц. B–лимфоциты дифференцируются в печени плода и костном мозге взрослого организма. NK–клетки образуются из предшественников лимфоидных клеток в костном мозге. Лимфоциты, как и другие лейкоциты, на своей поверхности экспрессируют большое количество различных молекул, по которым при помощи моноклональных АТ идентифицируют их принадлежность к конкретной клеточной популяции. Чаще всего с этой целью выявляют дифференцировочные антигены (CD), являющиеся специфичными клеточными маркёрами. Среди них различают линейные клеточные маркёры, маркёры созревания и активационные маркёры. Линейные клеточные маркёры — продукты генов, которые экспрессируются только в определённых клеточных типах. Примером линейного клеточного маркёра служит молекула CD3, которая присутствует только в T–лимфоцитах. Маркёр созревания, молекула CD1, экспрессируется в тимоцитах и исчезает в дальнейшем при их дифференцировке в периферические T–лимфоциты. Рецептор ИЛ2 — молекула CD25 — пример активационного маркёра, «выставляемого» на поверхности стимулированных антигеном клеток. Идентификация клеточных маркёров при помощи АТ используется в проточной цитометрии для сортировки и подсчёта количества клеток в исследуемых популяциях.
T–клетки
T–лимфоциты узнают антиген, предварительно процессированный и представленный на поверхности антигенпредставляющих клеток (рис. 11-5). T–лимфоциты (тимус-зависимые) ответственны за клеточныйиммунный ответ, а также помогают реагировать на антиген B–лимфоцитам при гуморальном иммунном ответе. T–клетки состоят из функциональных подтипов CD4+ и CD8+.
T–хелперы (TH) — CD4+ T–клетки. При активации синтезируют и секретируют цитокины (ИЛ2, ИЛ4, ИЛ5, ИЛ6,g-ИФН). В ходе иммунного ответа узнают молекулы MHC класса II.
Цитотоксические T–лимфоциты (TC) — CD8+ T–клетки, уничтожают инфицированные вирусом, опухолевые и чужеродные клетки при помощи перфорина. Взаимодействуют с молекулой MHC класса I в плазматической мембране клетки-мишени.
T–супрессоры (TS) — представители CD8+ T–клеток — регулируют интенсивность иммунного ответа, подавляя активность TH клеток; предотвращают развитие аутоиммунных реакций; защищают организм от нежелательных последствий иммунной реакции, от чрезмерного воспаления и аутоагрессии.
Дифференцировка T–лимфоцитов. Стволовая кроветворная клетка поступает из костного мозга в тимус, где протекает антиген-независимое созревание T–клеток. Здесь предшественники T–лимфоцитов начинают экспрессировать специфические маркёры: T–клеточный рецептор, CD2, CD3, CD4 или CD8 (рис. 11-5 и 11-6). Детальную информацию об антиген-независимой дифференцировке T–лимфоцитов см. в разделе «Тимус». Лимфопоэз контролируют многочисленные белки, связывающиеся с ДНК. Среди них недавно открытый факторIkaros, который в ряде случаев функционирует как типичный транскрипционный фактор.
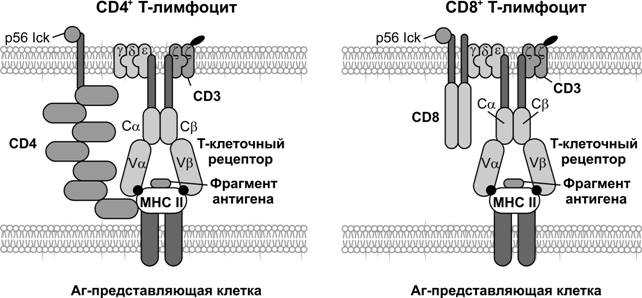
Рис. 11-5. T–клеточный рецептор и другие специфические маркёры T–клеток. [100]

Рис. 11-6. Механизм передачи внеклеточных сигналов с T–клеточного рецептора внутрь T–лимфоцита. Один из первых шагов в генерации иммунного ответа является узнавание T–клеткой пептидных фрагментов патогенов, представленных на поверхности антигенпредставляющей клетки. Активация T–клеточного рецептора стимулирует тирозинкиназы семейства Src (p56lck) и последующее фосфорилирование фосфолипазы C g 1. Активирование этой фосфолипазы вызывает гидролиз фосфатидилинозитолбифосфата (PIP2) с образованием диацилглицерола и инозитолтрифосфата (IP3). Диацилглицерол (DAG) активирует протеинкиназу С, а через неё молекулуRas (ГТФаза). Последующая активация молекулы Raf приводит к включению MAP киназного каскада. Инозитолтрифосфат вызывает освобождение Ca2+ из цистерн эндоплазматического ретикулума. Ca2+ связывается с кальмодулином, что активирует Ca2+/кальмодулин зависимую протеинфосфатазу. Прямой мишенью кальцинейрина служит транскрипционный фактор NFAT, регулирующий экспрессию гена интерлейкина 2 (ИЛ2). Кальцинейрин дефосфорилирует цитозольный компонент NFAT (NFATc), который импортируется в ядро и индуцирует транскрипцию гена ИЛ2. [101]
B–лимфоциты
B–лимфоциты ответственны за гуморальный иммунный ответ. В мембране B–лимфоцита присутствует рецептор антигена — мономер IgM. Из красного костного мозга B–лимфоциты мигрируют в тимус-независимые зонылимфоидных органов. Продолжительность жизни большинства B–лимфоцитов не превышает десяти дней, если они не активируются антигеном. Зрелые B–лимфоциты (плазматические клетки) вырабатывают АТ — Ig всех известных классов. CD19, CD20, CD22, CD79a и B–клеточный рецептор — основные маркёры, используемые для идентификации B–клеток.
B–клетки составляют от 5 до 15% лимфоцитов периферической крови и морфологически не отличаются от T-клеток. B–лимфоциты, в отличие от клеток других типов, характеризуются тем, что в процессе созревания их геном подвергается большому числу соматических перестроек ДНК. Обилие перестроек генома создает основу для онкогенных нарушений. Среди фенотипических маркёров B–лимфоцитов — IgM на поверхности недифференцированных клеток, IgM и IgD на поверхности зрелых неактивированных клеток, IgG, IgA или IgE на поверхности зрелых активированных B–лимфоцитов, а также дифференцировочные антигены CD19, CD20, CD21 (CR2), CD49c, CD72 и CD80. Основные маркёры, используемые для идентификации B–клеток, — CD19, CD20 и CD22. Важная роль в контактных взаимодействиях между T- и B–клетками принадлежит маркёру CD40, общему с дендритными клетками. B–лимфоциты экспрессируют белок главного комплекса гистосовместимости II класса (MHC II) и множество других молекул CD, неспецифичных для данного клеточного типа. MHC II (HLA-DP, HLA-DQ и HLA-DR) необходимы для взаимодействий с T–клетками в ходе иммунного ответа. Почти все B–клетки содержат рецепторы для компонентов комплемента C3b и C3d, через которые действуют сигналы клеточной активации и хоминга. На B–клетках имеются также Fc-рецепторы для IgG, передающие сигналы отрицательной регуляции.
B–клетки присутствуют в корковой части лимфатического узла, в его первичных и вторичных фолликулах, а также в мозговых тяжах. В селезёнке они легко могут быть обнаружены в краевой зоне и фолликулах. Антиген является основным фактором, контролирующим пролиферацию, дифференцировку и выживаемость B–лимфоцитов. В зависимости от того, на какой стадии дифференцировки B–лимфоцит вступает в контакт с антигеном, этот сигнал может вызывать пролиферацию, апоптоз или, наоборот, поддерживать дальнейшую дифференцировку клетки. Среди других сигналов, определяющих судьбу B–лимфоцита, имеет значение так называемый второй сигнал, действующий в центре размножения фолликула и поступающий от T–клеток (CD40-CD40L) в ходе межклеточных взаимодействий при иммунном ответе. Выживание B–лимфоцитов преимущественно контролируется лигандами, действующими через B–клеточный рецептор (BCR, B - C ell R eceptor).
Различают две субпопуляции B–клеток: B-1-клетки (Mac-1+, CD23−) и B-2-клетки (Mac-1−, CD23+). B-1-клетки спонтанно синтезируют так называемые нормальные антитела к определенным бактериальным антигенам, а также к аутоантигенам, таким как ДНК, Fc–фрагмент IgG, фосфолипиды и белки цитоскелета. B-1-клетки выявляются в крови новорожденных. К субпопуляции В-2-лимфоцитов относят стандартные B–клетки (CD23+).
B–клеточный рецептор и его активация
Выживание B–лимфоцитов поддерживают сигналы, действующие через B–клеточный рецептор в плазматической мембране (рис. 11-7). Он образован молекулой мембранного Ig (IgM), которая имеет гидрофобную последовательность, расположенную на C–концевом участке тяжёлой цепи и предназначенную для фиксации молекулы на клеточной мембране. Зрелый B–лимфоцит может содержать до 200 тыс. подобных молекул. Мембранный IgM кодируется тем же набором генов, что и сывороточные аналоги. С мембранным IgM связаны две добавочные молекулы Iga (CD79a) и Igb (CD79b), передающими сигнал внутрь клетки. Таким образом, одни Igфункционируют в составе антиген-распознающих рецепторов, а другие — присутствуют во внутренней среде как свободные молекулы (антитела). При взаимодействии подобного рецептора с лигандом (фактор роста, цитокин, антиген) происходит физическое сближение образованных комплексов лиганд–рецептор (образование кластеров). При этом цитоплазматические домены молекул рецептора, обладающие ферментативной активностью или постоянно связанные с ферментами, оказываются в непосредственной близости, фосфорилируют друг друга и другие молекулы, что приводит к активации внутриклеточного каскада. В передаче сигнала с B–клеточного рецептора внутрь клетки участвуют тирозинкиназы Blk, Fyn и Lyn, которые связаны с внутренней поверхностью мембраны липидным остатком на NH–конце. Активация рецептора и сближение цитоплазматических доменов, входящих в его состав молекул Iga и Igb (последовательности ITAM — I mmunoreceptor T yrosine A ctivation M otifs), сближает упомянутые тирозинкиназы с их последующим взаимным фосфорилированием, а также фосфорилированием по остатку тирозина цитоплазматических доменов молекул Iga и Igb. В результате в последовательности ITAM возникают сайты фосфорилирования, которые характеризуются высокой аффинностью к другим белковым молекулам, а именно фосфолипазе Сg, тирозинкиназе Syk и некоторым адапторным белкам. Все эти белки после связывания с сайтами фосфорилирования становятся мишенями тирозинкиназ Blk, Fyn и Lyn, фосфорилируются и активируются.
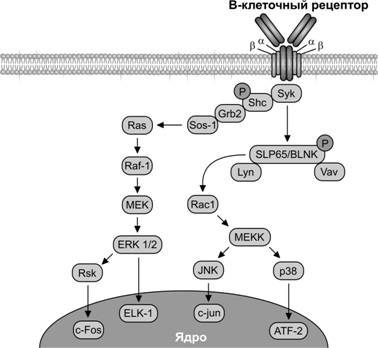
Рис. 11-7. B–клеточный антиген-распознающий рецептор состоит из двух одинаковых тяжёлых и двух одинаковых лёгких полипептидных цепей, соединённых дисульфидными связями, которые вместе образуют молекулу Ig. Связывание антигена с B–клеточным рецептором поддерживает активацию нескольких тирозинкиназ, которые вместе с тирозинфосфатазами регулируют фосфорилирование тирозина во многих молекулярных мишенях и в итоге контролируют гомеостаз покоящейся B–клетки. Фосфорилирование рецепторного комплекса отбирает и активирует молекулы тирозинкиназы Syk, которая в свою очередь, фосфорилирует молекулы фосфолипазы g, Shc и Vav. Адапторный белок SLP-65/BLNK активирует ключевые эффекторные белки. В передачу сигналов вовлекаются каскады Ras и киназыMEKK, которые фосфорилируют транскрипционные факторы, активирующие эффекторные гены. [101]
Активированная фосфолипаза Сg расщепляет мембранный фосфатидилинозитолбифосфат с образованием вторых посредников инозитолтрифосфата и диацилглицерола и последующей активацией каскада: Ca2+ ® кальмодулин® протеинкиназа С ® фосфорилирование многочисленных белков-мишеней, в том числе транскрипционных факторов ® активация генов ® пролиферация или усиление синтеза Ig.
Тирозинкиназа Syk фосфорилирует один из ключевых адапторных белков B–клеток — BLNK (B -cell L i nk er p rotein). BLNK, а также несколько других адапторных белков передают сигнал с B–клеточного рецептора на внутриклеточные пути RAS, MAP-киназный и другие. В итоге активируются транскрипционные факторы NF-kB, NFAT и AP-1, которые включают программу пролиферации и дифференцировки B–лимфоцитов.
Дифференцировка B–лимфоцитов
В онтогенезе дифференцировка B–лимфоцитов начинается в печени на 8–9 неделе развития, продолжается в красном костном мозге, где и поддерживается на протяжении всей жизни. Дифферон для B–лимфоцита выглядит следующим образом: стволовая кроветворная клетка ® общий лимфоидный предшественник В- и T–клеток ®ранний про-B–лимфоцит (про от англ. progenitor, предшественник) ® поздний про-B–лимфоцит ® большой пре-В-лимфоцит ® малый пре-B–лимфоцит ® незрелый B–лимфоцит ® зрелый B–лимфоцит (табл. 11-1).
Таблица 11-1. Гено- и фенотипические характеристики предшественников B–лимфоцитов
| Стволовая клетка | Ранний про-B–лимфоцит | Поздний про-B–лимфоцит | Большой пре-B–лимфоцит | Малый пре-B–лимфоцит | Незрелый B–лимфоцит | Зрелый B–лимфоцит | |
| Мембранные маркёры | CD34 | CD34 CD45 MHC II | CD45R CD19 CD40 MHC II | CD45R пре-B-R CD19 CD40 MHC II | CD45R пре-B-R CD19 CD40 MHC II | CD45R IgM CD19 CD40 MHC II | CD45R IgM IgD CD19 CD21 CD40 MHC II |
| Гены тяжёлой цепи Ig | зародышевой линии | D–J объединение | V-DJ объединение | VDJрекомбинированные | VDJрекомбинированные | VDJрекомбинированные | VDJ рекомбинированные |
| Гены лёгкой цепи Ig | зародышевой линии | зародышевой линии | зародышевой линии | зародышевой линии | V-J объединение | VDJ рекомбинированные | VDJ рекомбинированные |
| Ig в плазмолемме | Нет | нет | Нет | m цепь в пре-В-рецепторе | m цепь в цитоплазме и мембране | IgM | IgM и IgD |
| Заменяемая L цепь | Нет | есть | Есть | есть | нет | нет | нет |
m Цепь — один из 5 существующих вариантов тяжёлой цепи Ig, тяжёлая цепь IgM. Этот Ig может присутствовать в пентамерной или мономерной форме. Последняя представлена на поверхности B–клеток и выполняет функцию антиген-распознающего рецептора.
Процесс дифференцировки B–лимфоцитов в костном мозге стартует коммитированием стволовой кроветворной клетки. Источником инициирующего сигнала служат стромальные клетки костного мозга. В B–лимфоците по мере дифференцировки происходит становление антиген-распознающих молекулярных комплексов. Один из путей достижения их разнообразия — соматическая рекомбинация ряда генных сегментов, образующих полный V-ген. Молекула Ig состоит из двух тяжёлых (H-цепей) и двух лёгких (L-) цепей. Вариабельные V- и константные C-области каждой цепи (тяжёлой или лёгкой) кодируются двумя V- и C-генами, соответственно. При этом существует множество генов для вариабельных V-областей и один или весьма ограниченное число генов для константных C-областей. В незрелых B–клетках V- и С-гены той или иной группы сцепления Ig, находясь на одной и той же хромосоме, удалены друг от друга на значительное расстояние. По мере созревания B–клеток пространственно удаленные сегменты хромосомы оказываются в непосредственной близости, образуя единый информационный участок. Эта разновидность реорганизации генома и есть соматическая рекомбинация. Подобные изменения затрагивают геном только соматических клеток, поэтому не наследуются.
Ранние и поздние про-B–клетки характеризуются наличием соматических рекомбинаций ряда генных сегментов в группе сцепления D–J генов тяжёлой цепи Ig. Последующая стадия пре-B–клеток достигается в результате рекомбинации в группе сцепления V-DJ генов тяжёлой цепи Ig и характеризуется появлением цитоплазматических и поверхностных m цепей. Формирование незрелых B–лимфоцитов сопровождается перегруппировкой в группе сцепления V-J генов лёгких цепей Ig и встраиванием в клеточную мембрану IgM. Вышеупомянутые этапы дифференцировки B–клеток протекают независимо от антигена. Тем не менее, антиген может взаимодействовать с незрелым B–лимфоцитом, что лежит в основе феномена клональной инактивации, или толерантности. Если незрелые B–клетки не инактивированы, то они продолжают движение по дифферону, переходят в зрелые неактивированные клетки, покидают костный мозг и заселяют периферические лимфоидные органы. Здесь эти клетки при взаимодействии антигена с Ig, встроенным в их клеточную мембрану, превращаются в лимфобласты. Клетки этого типа, достигшие состояния терминальной дифференцировки, называют плазматическими. Они активно продуцируют и секретируют Ig строго определенного класса. Предшественники B–лимфоцитов, не завершившие дифференцировку, погибают путём апоптоза.
В CD34+–предшественниках цитокины индуцируют синтез рекомбиназ. В ранних про-B–лимфоцитах D–J участки в хромосомах, содержащих гены тяжёлых цепей Ig, сближаются. На этой стадии клетки начинают экспрессировать молекулы CD45 и MHC II. На последующей стадии позднего про-B–лимфоцита завершается процесс объединенияV сегмента с участком D–JH. Переход от про- к пре-B–лимфоциту характеризуется появлением в клеточной мембране m цепей вместе с заменяемыми (суррогатными) легкими цепями в составе предшественника B–клеточного рецептора. Эти цепи по мере дальнейшей дифференцировки заменяются дефинитивными лёгкими цепями. Цитоплазматические хвосты тяжёлых цепей молекулы Ig на этом этапе дифференцировки пока ещё проникают в цитоплазму на незначительное расстояние и не участвуют в передаче сигнала внутрь клетки в ответ на взаимодействие с антигеном.
В про-B–лимфоците в ответ на связывание антигена с B–клеточным рецептором передающие сигнал молекулы Igaи Igb фосфорилируются по тирозину в последовательности ITAM. В результате этого фосфорилирования запускается цитоплазматический сигнальный каскад. В клетке приостанавливается рекомбинация тяжёлой цепи, инициируется пролиферация и образуется клон клеток, содержащих идентичную m цепь. Т.к. на этой стадии делящиеся клетки имеют большие размеры, чем клетки в состоянии покоя, эти более крупные клетки называют большими пре-B–лимфоцитами.
Постмитотические малые пре-B–лимфоциты характеризуются объединением V-J участков хромосомы, ответственных за синтез лёгкой цепи. Будучи синтезированной, эта цепь экспрессируется вместе с m цепью на поверхности незрелого B–лимфоцита. Незрелые B–лимфоциты очень чувствительны к действию антигена. Если они взаимодействуют с собственными антигенами, находясь в костном мозге, они погибают. Незрелые B–клетки завершают этап костномозгового развития, активно экспрессируют поверхностный Ig и находятся в стадии отбора на способность взаимодействовать с собственными антигенами. Зрелая B–клетка — клеточный тип периферии, способный взаимодействовать только с чужеродными антигенами. B–клетки, которые не взаимодействуют с собственным антигеном, экспрессируют m цепь и мембранные формы IgD и IgM. Подобные клетки покидают костный мозг, становясь неактивированными зрелыми B–лимфоцитами. Заключительная стадия рассматриваемого дифферона — плазматическая клетка (плазмоцит) — эффекторная Ig-продуцирующая клеточная форма, которая образуется из зрелой B–клетки после ее контакта с антигеном.
NK–клетки
NK–клетки составляют до 10% всех лимфоцитов крови, не имеют поверхностных детерминант, характерных для T- и B–лимфоцитов (MHC-нерестригированные киллеры), не имеют рецептора T–лимфоцитов. NK–клетки убивают ауто-, алло- и ксеногенные опухолевые клетки, инфицированные некоторыми вирусами и бактериями (например, Salmonella typhi) клетки. В типичных NK–клетках экспрессируются дифференцировочные молекулы CD2, СD7, CD56 и CD16 (рецептор Fc–фрагмента IgG). В плазматической мембране активированных NK–клеток появляется гликопротеин CD69. Механизм распознавания неясен. Существует представление о трёх семействах поверхностноклеточных молекул, защищающих клетки организма от цитотоксического действия NK–клеток. Примером служит продукт гена HLA-C. Распознавание рецептором NK–клетки этой молекулы тормозит цитотоксическую активность NK–клеток и таким образом защищает клетку, экспрессирующую HLA-C. Модификация продукта гена HLA-C вирусами или связанными с опухолью молекулами приводит к уничтожению этой клетки NK–клеткой. NK–клетки, располагая рецептором IgG (CD16), способны также взаимодействовать с клетками, окружёнными молекулами IgG, и убивать их (феномен АТ-зависимой цитотоксичности). Активированные NK–клетки выделяют g-ИФН, ИЛ1, GM-CSF. При активации (например, под влиянием ИЛ2) NK–клетки приобретают способность к пролиферации. Функция NK–клеток нарушена при синдромеШедьяка-Хигаси. Дефект NK–клеток — причина хронических инфекций.
· Цитолиз. В отличие от цитотоксических T–лимфоцитов, способность NK–клеток к цитолизу не связана с необходимостью распознавания молекул MHC на поверхности мишени. NK–клетки уничтожают клетку-мишень не путём фагоцитоза, а (после установления с ней прямого контакта) при помощи перфорина.
· Гуморальная регуляция. Активность NK–клеток регулируется цитокинами. g-ИФН и ИЛ2 усиливают цитолитическую активность NK–клеток.
· Участие в антителозависимом клеточно-опосредованном цитолизе. NK–клетки, наряду с макрофагами, нейтрофилами и эозинофилами, участвуют в АТ-зависимом клеточно-опосредованном цитолизе. Для этого NK–клетки экспрессируют на своей поверхности рецептор Fc–фрагмента IgG (CD16). Реакция зависит от присутствия АТ (Ig), узнающих клетку-мишень и связывающихся с ней. Fc–фрагмент связанных с клеткой-мишенью АТ взаимодействует с рецептором Fc–фрагмента, встроенным в плазматическую мембрану NK–клетки. Природа агента, убивающего клетку-мишень в этом случае, неизвестна.
|
|
|
|
|
Дата добавления: 2014-12-23; Просмотров: 1428; Нарушение авторских прав?; Мы поможем в написании вашей работы!