
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ерітіндіден конденсация 3 страница
|
|
|
|
Коагуляциялық құрылымдардың ерекше қасиеті: Бұзыл-ғаннан кейін және бұзылуға әкелген жүктемені алғаннан кейін құрылым мен оның беріктігі қайта пайда болады. бұл эффектіні тиксотропия деп атайды.
Коагуляциялық құрылымдардың тиксотпориялық қасиет-тері көптеген технологиялық процестерде шешуші роль ат-қарады. Мысалы майлы бояулар жаққан кезде сұйылып, кейін қату керек. Көптеген биологиялық жүйелер (протоплазма, бұлшық еттің талшықтары) үшін тиксотропиялық қасиеттер тән.
Коагуляциялық құрылымдарға тән басқа физика-химиялық қасиетті синерезис, не коллапс деп атайды. Синерезис дегеніміз құрылым ұяшықтарындағы сұйық бөлініп, гельдің өлшемдерінің өздігінен кішіреюі. Оның термодинамикалық себебі – гельдер-дің тепе-теңдіксіз күйі. Мұндай күй дисперстік фазаның үлкен ауданымен қатар гель құрылымының борпылдақтығына бай-ланысты. Себебі тығыз құрылымға қарағанда борпылдақта коалесценциялық контактілер саны аз болады. Белгілі жағдайда гельдің көлемі күрт кішірейіп, нәтижесінде тығыз құрылым түзіледі. Гельдер синерезисінің (коллапсының) тағы бір (хи-миялық) механизмі болуы мүмкін. Мысал ретінде полиакрил-амидтың гельдерін алайық. Мұндай гельдерді суға енгізсе, зарядталған полиакрил қышқылының түзілуіне әкелетін баяу гидролиз жүреді. Қарсы иондардың электрлік тебілу әсерінен гельдің көлемі ұлғаяды (ісінеді). Суға ацетон қосса, белгілі концентрацияда (~40 %) гельдің көлемі күрт кішірейеді. Бұл жүйедегі гель коллапсының себебі – полимердің ацетондағы нашар ерігіштігі. Полиакрил қышқылының зарядталған сегмент-тері түзілмей, полимер макромолекулалары арасында тартылу күштері басым болады. Гель суда неғұрлым көбірек болса, бұл эффект соғұрлым күштірек болады.
12./ Лиофобты жүйелердің тұрақтылық теориясындағы сынама қысымының электрстатикалық құрамдасы. Зольдерді электролиттермен концентрациялық және бейтараптандыратын коагуляцияның тәртібі.
Лиофобты дисперсті жүйелерді (суспензия, золь, эмульсия) синтездеу диспергирлеу және конденсация әдістерімен жүргізіледі. Таңдалған орталардағы қатты және сұйық заттардың диспергирленуін шарлы және коллоидты диірмендерде, ультра дыбысты қондырғыларда жүргізіледі. Диспергирлеу әсері ортаға БАЗ енгізген кезде күшейеді. Конденсациялық әдістер көлем (газ тәрізді, сұйық не қатты) көлемінде таралған дисперсті бөлшектер түріндегі жаңа фазаның түзілуімен жүретін атомдар немесе молекулалардың физикалық немесе химиялық конденсациясына негізделген.
Физикалық конденсация әдісімен золь, түтін, дисперсті металлдарды алады. Химиялық конденсация кезінде жаңа фазаның бөлшектері, жүйеде аз еритін қосылыстардың түзілуінің нәтижесінде құрылады.
Дисперсті жүйелердің түзілуінің конденсациялық әдісі метатұрақты күйдегі гомогенді жүйеден жаңа фазаның бөлінуімен байланысты, мысалы аса қаныққан ерітіндіден кристаллизация, аса қаныққан будың конденсациясы. Бұл процесс химиялық потенциал ескі фазаға қарағанда жаңа фазада азырақ болған жағдайда ғана жүреді. Жаңа фазаның түйіндерінің түзілуіне жағдай, қажетті өлшемдегі тығыздық флуктуациясының түзілетін орындарында, яғни метатұрақты жүйелерде туындайды. Туындайтын түйіндер үлкен тепе теңдікті бу қысымына немесе беттің үлкен қисықтығына байланысты жақсы ерігіштікке ие болғандықтан, аса қанығушылық қажетті фактор болып табылады. Жаңа фазаның тепе теңдікті түйінінің радиусы белгілі тәуелділіктің қанығу дәрежесімен байланысты. (аса қаныққан буда түзілетін сұйық тамшы үшін):

Мұндағы Vm – сұйық тамшының молярлы көлемі мен беттік керілуі;
Ра.қ және Рқ – сәйкесінше аса қаныққан және қаныққан будың серпімділіктері; аса қанығу дәрежесі үлкен болған саын, түйіннің тепе теңдікті өлшемі де кем болады, соғұрлым оңайырақ түзіледі.
Лиофобты дисперстік жүйелер термодинамикалық тұрақсыз және дисперсті фазаның бөлшектері агрегацияға бейім болып келеді. Олардың термодинамикалық агрегатты тұрақсыздығы беттік энергияның артық мөлшерімен түсіндіріледі. Дисперсті лиофобты жүйелер лиофилді жүйелер сияқты өздігінен диспергирлеу арқылы алынбайды; олардың түзілуі үшін сыртқы энергия жұмсалуы керек. Агрегативті тұрақтылық жойылған жағдайда дисперсті фаза бөлшектерінің іріленуі изотермиялық айдау немесе коагуляция нәтижесінде қол жеткізіледі. Коагуляция процесі кеңінен қолданылуда. Дисперсті фазаның концентраациясы мен жүйе табиғатына байланысты бұл процесс аяқталуы мүмкін немесе бөлшектер тұнып не құрылым түзілуге ұшырауы мүмкін. Бірігуге қарсы бөлшектерге тұрақтылық беру үшін бөлшектердің бетінде қорғаныш қабатын құру керек, яғни электростатикалық тебілістің туындауына әкелетін қос электрлік қабат, сонымен қатар бөлшектердің жабысуы мен құрылымдық механикалық қасиеттерінің жанасуына кедергі жасайтын сольватты және адсорбционды сольватты қабаттарды құру керек. (тұрақтылықтың құрылымдық факторы). Агрегативті тұрақтылықпен қатар седиментациялық тұрақтылық та кездеседі, яғни бұл ауырлық күшінің әсерінен бөлшектердің тұнуына қарсы тұрақтылық түрі. Бөлшектердің тұнуына диффузия кедергі келтіреді, ол оларды барлық көлем бойынша біркелкі таратуға ұмтылады.
Физикалық конденсацияны әр түрлі жолдармен жүргізуге болады, мысалы бір заттың буын басқаға жіберу арқылы, еріткішті ауыстыру әдісі арқылы; қандай да бір заттың ерітіндісін біртіндеп араластыру арқылы осы зат ерімейтін сұйықтыққа қосады. Бұл кезде молекулалардың конденсациясы жүреді және коллоиды бөлшектер түзіледі.
Егер химиялық реакция кезінде қиын еритін қосылыс түзілетін болса, онда белгілі бір жағдайларда коллоидты ерітінді түрінде түзілуі мүмкін. Бұл үшін реакцияны сұйытылған ерітіндіде жүргізеді, себебі кристаллды бөлшектердің өсу қарқыны үлкен болмауы керек, сонда бөлшектер ұсақ болып, жүйеде седиментациялық тұрақтылық орнайды. Кристалл бетінде ҚЭҚ, яғни агрегативті тұрақтылықтың негізгі факторы түзілу үшін, әрекеттесуші заттың бірін артық мөлшерде алу керек. Коллоиды ерітінділердің құрылымдық бірлігі ретінде электробейтарап бөлшек мицелла алынады. Оның құрылысы формула түрінде көрсетіледі. Мысал ретінде коллоидты ерітінді темір (ІІІ) гидроксидінің золінің коллоидты ерітіндісінің түзілуін қарастырайық.
Темір гидроксиді гидрозолін темір хлоридінің гидролизін 100 ̊С реакциясын жүргізу арқылы конденсация әдісімен синтездейді.

Гидролиз реакциясы жоғары дисперсті суда ерімейтін бөлшектердің түзілуі арқылы интенсивті түрде жүреді. Мицелла негізінде осы дисперстік ортада ерімейтін бірнеше молекулалардан тұратын агрегат жатыр.

Мұндағы n – агрегат құрамына кіретін молекула саны.
Агрегат беті, дисперсиялы ортадан иондардың таңдамалы адсорбциясының нәтижесінде немесе агрегаттың беттік қабатындағы молекулалардың диссоциациясының нәтижесінде зарядталуы мүмкін. Песков – Фаянс ережесіне сәйкес, агрегаттың құрамына кіретін иондар немесе олармен айрықшалықты әсерлесетін иондар жақсы адсорбцияланады. Агрегаттың беттік зарядын анықтайтын иондар, потенциал анықтағыш деп аталады. Зарядталған агрегат мицелла ядросын құрайды. Темір гидроксиді золін алудың осы әдісінде, ядро, Ғе3+ ионының ортадан адсорбциясының есебінен немесе агрегаттың беттік молеукулаларының НСl молеукласымен келесі реакция бойынша әрекеттесуінің есебінен оң беттік зарядқа ие: 
Бұл агрегат маңында ҒеО иондарының болуына әкеледі. Осылайша мицелла ядросын келесі сызбалармен көрсетуге болады
 Мұндағы m – адсорбцияланған иондар саны.
Мұндағы m – адсорбцияланған иондар саны.
Концентрациялық және бейтараптық коагуляция. Концентрациялық коагуляция коллоидтық ерітінділердің компоненттерімен әрекеттеспейтін электролиттің концентрациясының артуына байланысты. Мұндай электролиттерді индифферентті деп атайды. Олардың иондары мицелланың ядросын толықтырмайды және потенциал анықтаушы иондармен әрекеттеспейді. Индифферентті электролиттердің концентрация-сының артуымен мицелланың диффузиялық қабаты сығылып, адсорбциялық қабатқа өтеді. Нәтижесінде ζ-потенциал азайып, нольге теңесуі мүмкін. ζ-потенциалдың кемуімен коллоидты ерітінділердің агрегаттық тұрақтылығы азаяды, ζ-потенциалдың критикалық мәнінде коагуляция жүреді. Мұнда термодинамикалық потенциал өзгермейді.
Бейтараптық коагуляция жүргенде енгізілген электролиттердің иондары зарядты бейтараптайды, термодинамикалық потенциал мен электркинетикалық потенциал азаяды.
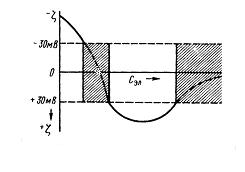 Коллоидтық ерітінділерге көп валентті қарсы зарядталған иондары бар электролитті енгізсе, золь басында тұрақты болады, концентрацияның белгілі аралығында коагуляция жүреді, кейін қайта тұрақтанады және электролиттің көп мөлшерінде қайтымсыз коагуляция жүреді.
Коллоидтық ерітінділерге көп валентті қарсы зарядталған иондары бар электролитті енгізсе, золь басында тұрақты болады, концентрацияның белгілі аралығында коагуляция жүреді, кейін қайта тұрақтанады және электролиттің көп мөлшерінде қайтымсыз коагуляция жүреді.
Бұл құбылыстың механизмін қарастырайық. Басында көп зарядты иондардың мөлшері зольді коагуляциялау үшін жетпейді. Мұнда ζ-потенциалдың шамасы критикалық мәнінен үлкен. Электролит мөлшерінің артуымен оның иондары коагуляциялағыш әсер көрсетеді. Концентрацияның осы аралығында ζ-потенциал 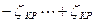 аралығында өзгереді. Ары қарай концентрацияның артуы коллоидтық бөлшектердің қайта зарядталуына әкеледі, яғни золь тұрақтанады. Бұл зонада (аймақта)
аралығында өзгереді. Ары қарай концентрацияның артуы коллоидтық бөлшектердің қайта зарядталуына әкеледі, яғни золь тұрақтанады. Бұл зонада (аймақта)  , электролит концентрациясының артуымен көп зарядты иондар зольді толық және және қайтымсыз коагуляциялайды.
, электролит концентрациясының артуымен көп зарядты иондар зольді толық және және қайтымсыз коагуляциялайды.
13./ Конденсациялық құрылымдар қандай контактылармен байланысқан Қандай түрлері бар мысал келтіріп түсіндіріңіз Олардың қасиеттері мен қолдануын атап өтіңіз. Конденсациялық құрылымдар негізіннен фазалық контактілер арқылы түзіледі. Ерекшелиги – олардың ауданы молекуланың өлщемдеріннен едауір артық және бөлшектер арасындағы әрекеттесу когезиялық күштермен анықталады.
Екі негізгі сипаттамасын қарастыра аламыз. Олар конденсациялық құрылымдар мен кристалдық құрылымдар. Конденсациялық құрылымдар- сұйылтылған балқытпа аса қаныққан ерітінділерден қатты аморфты бөлшектер алғанда түзіледі. Кристалдық құрылымдар – кристал дисперсті бөлшектердің бірігу нәтижесінде пайда болған обьектілерін айтады,бірақ сынғыш келеді. Макромолекулалық полярлы және полярсыз құрылымның болуы полимерлердің түзілуіне алып келеді. Әрбір типтегі құрылымдар арқылы күрделі құрылымдар түзіледі. Олар тартылу жане тебису күштерінің асериннен бірігеді.
Конденсациялық құрылымдар. Конденсациялық құрылым-дар фазалық контактілер арқылы түзіледі. Фазалық контактілер-дің ерекшелігі – олардың ауданы молекулалық өлшемдерден едәуір артық (үлкен) және бөлшектер арасындағы әрекеттесулер когезиялық күштермен анықталады. Осы себептен коагуляция-лық контактіге қарағанда, фазалық контактілердің беріктігі жоғары болады.
Фазалық контактілер мен оларға сәйкес құрылымдар кон-денсациялық және кристалдық деп бөлінеді. Конденсациялық құрылымдар суытылған (қатырылған) балқытпа немесе аса қаныққан ерітінділерден қатты аморфты бөлшектерді алғанда түзіледі. Конденсациялық құрылымдарға силикагельдер мен алюмосиликаттар жатады. Натрий силикатының қышқылымен әрекеттесу нәтижесінде силикагельдер аморфты фаза түзеді. Коагуляциядан кейін түзілген кремний қышқылының золі гель түзеді. Дисперстік ортаның (Na2SiO3) аса қанығуына байланыс-ты гельдің дисперстік бөлшектері бірігіп, фазалық контактілер түзеді.
Кристалдық құрылымдар кристалдық дисперстік бөлшек-тердің бірігу нәтижесінде пайда болады. Мұндай құрылым-дардың типтік өкілі – поликристалдық металдар мен минерал-дар.
Фазалық контактісі бар құрылымдар коагуляциялық контактілерге қарағанда берік болады және берік, бірақ сынғыш материалдарға ұқсас болады. Олар пластикалық диформацияға қабілетті және тиксотропиялық қасиеттерді көрсетпейді.
Бірінші типтегі кеңістіктік құрылымдар суспензиялар және зольдермен қатар полимерлердің ерітінділерінде де пайда болады. Макромолекулалардың анизотроптылығы және поли-мерлі тізбектердегі полярлы мен полярсыз топтардың болуы полимер ерітінділерінің құрылымдануына әкеледі. Мұндай ерітінділерде дисперсиялық әрекеттесулер не сутекті байланыс-тар арқылы тиксоторопты құрылымдар түзіледі, немесе макро-молекулалар арасындағы химиялық әрекеттесулер нәтижесінде қайтымыз конденсациялық құрылымдар пайда болады.
Бөлшектері ұсақ агрегаттық тұрақты жүйелерде екінші типтегі құрылымдар пайда болады, яғни олардың потенциалды қисықтарында екінші энергиялық минимум болмайды. Сонымен қатар мұндай жүйелерде бірінші минимумда да бөлшектер әрекеттесе алмайды. Сондықтан осындай тұрақты жүйелердегі құрылымдар тартылу емес, тебісу күштері арқылы түзіледі. Құрылым түзілу үшін дисперстік фаза концентрациясын арттыру арқылы «тарығу жағдайын» туғызу керек. «Тарығу жағдайына» бөлшектердегі беттік қабаттар (адсорбциялық, сольваттық, қос электрлік) әкелуі мүмкін. Нәтижесінде бөлшек-тің көлемі өзінікінен үлкен болып, оны «тиімді көлем» деп атайды. Бөлшектің өз көлемінен тиімді көлемі едәуір үлкен болуы мүмкін.
Бөлшектердің тиімді көлеміне ұқсас дисперстік фазаның тиімді көлемдік концентрациясы (φ т) деген ұғым бар. Ол дисперстік фазаның көлемдік үлесі (φ) мен беттік қабаттардың көлемдік үлесінің (φ б.қ.) қосындысына тең:
φ т = φ + φб.қ.
Дисперстік фазаның белгілі мөлшерінде φ т ≥ φ max шарты орындала бастайды. Мұндағы φ max – бөлшектердің тығыз орналасуына сәйкес концентрация (ықтималдылығы жоғары статистикалық орналасу үшін φ max ~ 0,62 ÷ 0,64). Бұл кезде беттік қабаттар айқасып, бөлшектер тебісу энергиясы нольге тең болатындай қашықтыққа дейін алшақтай алмайды. Осылай жүйеде «тарығу жағдайы» пайда болады. Беттік қабаттарының өзара тебісу нәтижесінде бөлшектер энергиялық тиімді орна-ласып, жүйеде үш өлшемді реттелген қайтымды құрылым түзіледі.
Аралас құрылымдарда бірінші де, екінші де типтердің фрагменттері болады. Аралас құрылымдар әдетте полидисперсті суспензияларда немесе бөлшектерінің табиғаты әртүрлі жүйе-лерде түзіледі. Мұндай жүйелерде бір түрлі бөлшектер (мысалы, ірі бөлшектер) коагуляциялық тор түзеді, ал тордың саңы-лауында екінші түрдегі бөлшектер екінші типтегі құрылым түзеді.
Конденсациялық әдістер арқылы коллоидтық жүйені алуды кристаллизация процесі сияқты қарастырады. Ал бұл әдіспен алынған бөлшектер өте кіші кристалл бөлшектер ретінде қарастырылады. Конденсациялық әдісті алғаш зерттеген Л.Л. Веймарн.
Кристалдардың түзілуі екі сатыда жүреді:
1. Бастапқы туынтектің (кристаллизация орталығының) пайда болуы.
2. Бастапқы туынтектердің өсуі. Бұдан біршама ірі кристалдар түзіледі.
Химиялық конденсациялық әдістер
1.Тотықсыздандыру реакциясы:
2HAuCl4 + 3H2O2 → 2Au + 8HCl + O2
Бұл реакцияны алғаш Зигмонди қолданғандықтан кейде Зигмонди әдісі деп те атайды.
2. Тотықтыру реакциясы, оған сулы ортада күкірттісутекті тотықтыру арқылы күкірттің гидрозолін алу жатады.
2 H2S + O2 → 2S + H2O
3.Гидролиз реакциясы. Бұл әдісте ыстық суға темір (III) хлоридінің аз мөлшерін қосып, темір (III) гидрооксидінің золін алу жатады:
FeCl3 + 3H2O → Fe(OH) 3 + 3HCl
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 1852; Нарушение авторских прав?; Мы поможем в написании вашей работы!