
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Алмасу реакциясы 1 страница
|
|
|
|
AgNO3 + KI → AgI +KNO 3
Hg (CN)2 + H2S → HgS + 2HCN және т.б.
5. Гидротермалды синтез – қазіргі замандағы бейорганикалық дисперстік бөлшектерді алудың тиімді тәсілі. Бұл әдіс р>1 атм қысым мен 100оС – тан жоғары температурада жүргізіледі.
6. Cольвотермалды синтез - органикалық дисперстік
бөлшектерді алу үшін судың орнына органикалық еріткіштерді алады.
7. Гидротермалды –электрохимиялық синтез - мұнда сілті ерітіндісінде метал электролизі жүргізіледі
8. Гидротермалды – микротолқынды әдісте қыздыру жылдамдығын тиімді өсіруге болады.
Физикалық конденсациялық әдістер
1. Молекулалық шоғырлар әдісі
2. Аэрозольдік әдіс
3. Тозаңдатқыш кептір
4. Криохимиялық синтез
5. Плазмалық әдіс
6. Золь-гель әдісі. Бұл әдісті коллоидтық ерітіндіден (кірнеден) жоғары дисперстік қатты бөлшектерді (нанобөлшектерді) бөліп алу үшін қолданады.
7. Еріткішті алмастыру әдісі. Бұл әдісті зольдің қатты бөлшектерін алу үшін пайдаланады. Берілген заттың ерітіндісін үнемі араластыра отырып, осы зат ерімейтін сұйықтыққа құяды.
14./ Ньютондық және ньютондық емес сұйықтықтардың айырмашылығын түсіндіріңіз
Кеңістіктегі құрылымдардың түзілу қасиеті дисперсті жүйенің көлеміндегі бөлшекердің таралуына және бөлшектер арасындағы контактілердің түрімен беріктігіне байланысты болғандықтан,оларды құрылым механикалық депатайды.Дисперсті жүйелердің құрылым механикалық қасиеттерін реологиялық әдістердің көмегімен зерттейді.Маңызды реологиялық сипаттамаларға тұтқырлық, серпімділік, иілгіштік, беріктік жатады.Оларды анықтау үшін сыртқы механикалық кернеудің (P) әсеріннен болатын деформациялар γ (жүйенің бірыңғайлылығы бұзылатын нүктелердің ығысуы) меен олардың уақытқа тәуелділігін зерттейді.
Өздеерінің реологиялық тәртібі бойынша дисперсті жүйелер сұйық тәрізді (Pт=0) қатты тәрізді (Рт>0) деп бөлінеді.Сұйық тәрізді жүйелердің өзін ньютон және ньютондық емес деп жіктейді.Ньютондық жүйелердің тұтқырлығы кернеудің шамасына тәуелсіз.Кеңістіктегі құрылымдар пайда болған жағдайда дисперсті жүйелеердің ағуы Ньютондықтан ауытқып, олардың тұтқырлығы берілген жүктеемеенің шамасына тәуелді болып, тиімді (эффективті) деп аталады.
Ньютондық дисперсті жүйелер. Дисперстік фазаның аз концентрациясы мен құрылымдар түзілмеген жағдайда көптеген дисперсті жүйелердің тәртібі ньютондық сұйықтықтарға сәйкес болады.Мұндай жүйелеердее тұтқырлықтың дисперсті фаза концеентрациясына тәуелділігі Энштейн теңдееуі арқылы беейнеленеді:
η = η0(1+αφ) ηмен=(η-η0)\η0=αφ, мұндағы η,η0, ηмен дисперсиялық ортаның, дисперсті жүйенің және мееншікті тұтқырлықтар; φ көлемдік үлес бойынша алынғандисперстік фазаның концентрациясы; α бөлшектеер формасының конце бөлшектеер формасының коэфиценті.
Тұтқырлықтың есептелмеген шамаларының тәжірибелерден анықталмаған шамалардан айырмашалығы жүйедегі бөлшектердің әрекеттесуін көрсетеді.Сонымен,қатар Энштейн теңдеуіннен ауытқуы фазааралық беттерде қалыңдығы δ бөлшектердің өлшемдеріне жақын,жақсы дамыған беттік қабаттардың (ҚЭҚ,сольваттық,адсорбциялық)болуына байланысты.Осы жағдайда Энштейн теңдуі былай жазылады. η=ηо(1+αφэф) Мұндағы αφэф дисперсті фазаның тиімді концентрациясы.
Егер бөлшектер сфералық болып,олардың диаметрі d мен концентрациясы φ белгілі болса,жүйенің тұтқырлығын анықтап,беттік қабаттардың қалыңдығын бағалауға болады.Ол үшін Энштейн теңдеуі φэф,одан кейін δ мәнін табуға болады.
δ=d/2 *[(φэф/φ)1|3-1]
Ньютондық емес дисперсті жүйелер. Н.е.д.жүйелердің реологиялық тәртібі ондағы түзілетін құрылымдарға байланысты.Мұндай құрылымдар бөлшектер арасындағы беттік күштердің тепе теңдігімен,яғни потенциялды құрылымдардың түрімен анықталады.
Осылай, дипеерсті жүйелердің құрылым механикалық қасиеттеерін зерттей отырып, түзілетін құрылымдардың түрі мен бөлшектер арасындағы байланыстардың параметрлеерін (беріктігін) анықтауға болады.
15./ Наноөлшемді бөлшектерде магнитті қасиеттерінінің ерекшелігін түсіндіріңіз. Диамагнетиктер, парамагнетиктер және ферромагнетиктер дегеніміз не. Олардың пайдалану аймақтарын атаңыз
Магнитті қасиеттері Көптеген бейорганикалық заттар магнитті өткізгіштік (µ)қасиеттерге ие. Осыған байланысты заттар парамагнитті (µ≥1) немесе диамагнитті (µ≤1) кластарға бөлінеді. Нанобөлшектердің магнитті қасиеттері макробөлшектерден айтарлықтай айырмашылығы бар. Магниттік қасиеттердегі размерлік эффект Кюри нүктесінің төмендеуінен көрінеді. Мысалы, Fe, Co, Ni нанобөлшектерінің Кюри нүктесі олардың макроскопиялық үлгілерінен жүздеген градусқа төмен болады.
Магниттік қасиеттерді негізгі уш топка бөліп қарастыруға болады; диамагнетик, парамагнетик, ферромагнетиктер.
Диамагнетизм (грекше. dia – қалшақтау немесе магнетизм) – магнитті аймаққа қойылған затқа қарама қарсы магниттік қасиеттері бар заттар.
Сыртқы өріс болмаған жағдайда атомдардың магниттікмоменті нөлге тең болғанда, яғни атомдардың барлық электрондарының магниттік моменттері бір бірімен компенсацияланады (мысалы, сутек, инертті газдар, азот, NaCl және т.б.).
Диамагнитті заттарды магниттік өріске енгізгенде, оның атомдары магниттік моменттерге ие болады. Изотропты диамагнетиктердің аз көлемі шамасында Δ V барлық атомдардың бағытталған магниттік моменттері бірдей және векторға қарама қарсы орналасқан.
Диамагниттің магниттік векторы тең: 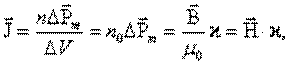
мунда n 0 – атомдар концентрациясы, 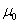 – магниттік тұрақтылық,
– магниттік тұрақтылық, 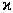 –магниттік ортаға сіңісу
–магниттік ортаға сіңісу
Барлық диамагнитиктер үшін  Осылайша, вектор
Осылайша, вектор  меншикти магнитті аймақтың магнит индукциясы,
меншикти магнитті аймақтың магнит индукциясы,  сырткы магниттену аркылы диамагнетиктің пайда болуы
сырткы магниттену аркылы диамагнетиктің пайда болуы  карама карсы бағытка багытталған. (электриктік аумақтагы диэлектрлерге караганда)
карама карсы бағытка багытталған. (электриктік аумақтагы диэлектрлерге караганда)
Диамагниттерде 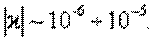
Парамагнетизм (грекше. para – жақын, маңында және магнетизм) – сыртқы магнит өрісіндегі заттар қасиеттерінің магниттеліп, сондықтан парамагнетик ішінде сыртқы өріс әсеріне бағытталған магнит өрісі әсері қосылады.
Парамагнетиктер - Сыртқы магнит өрісі болмағанда атомдары нөлден ерекшеленетін магниттік моментке 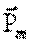 ие заттар. Бұл заттар вектор
ие заттар. Бұл заттар вектор 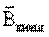 бағытында магниттеледі. Парамагнетиктерге сілтілік металдар, оттек
бағытында магниттеледі. Парамагнетиктерге сілтілік металдар, оттек 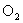 азот оксиді NO, темірсульфиді
азот оксиді NO, темірсульфиді 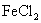 жатады.
жатады.
Сыртқы магнит өрісі болмағанда парамагнетиктің магниттелуі  , себебі әр түрлі атомдардың векторы
, себебі әр түрлі атомдардың векторы 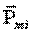 хаосты орналасқан.
хаосты орналасқан.
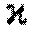 мәні парамагнетиктер үшін оң (
мәні парамагнетиктер үшін оң ( ) және и находятся в пределах
) және и находятся в пределах  шегінде орналасады, яғни диамагнетиктердікіндей.
шегінде орналасады, яғни диамагнетиктердікіндей.
Ферромагнетиктер жоғары оң магниттік қабылдауға ие. Алдыңғы материалдарға қарағанда, ферромагнетиктердің қабылдауы белгілі бір мөлшерде температура мен магниттік өріс кернеулігіне ие. Ферромагнетиктер компенсирленбеген антиферромагнетизм ерекшеленеді. Олардың магниттік қабылдауы магниттік өріс кернеулігіне ие. Алайда бұл жағдайда бірқатар ерекшеліктерге ие. Мұндай қосылыстарға әртүрлі оксидтік қосылыстар жатады.
Келтірілген барлық магнетиктерді тағы да екі категорияға бөледі. Яғни магниттік жұмсақ және магниттік қатаң материалдар. Магниттік қатты коэрцивтивті күш жоғары мәнге ие заттар жатады. Оларды қайта магниттеу үшін күшті магниттік өріс жасау керек. Мұндай магнетиктерді тұрақы магнетиктер дайындауда қолданады.
16./ Нанодисперсті жүйелердің физикалық қасиеттері. Нанобөлшектердің колоидтық химиясы өлшемдеріне термодинамикалық қасиеттердің тәуелділігін түсіндіріңіз (балқу температурасы мен энтальпиясы, жылу сыйымдылығы)
Нанодисперсті жүйелердің физикалық және химиялық қасиеттері
Жоғары дисперсті және ультрадисперсті бөлшектердің негізгі ерекшелігі - олардың қасиеттерінің химиялық құрамына ғана емес, сонымен қатар бөлшектердің өлшемдеріне (размерлеріне) байланысты. Бөлшек қасиеттерінің оның өлшеміне тәуелділігі өлшемдік немесе маcштабтық эффект деп аталады.
Термодинамикалық қасиеттері: балқу температурасының төмендеуі
Әр түрлі заттардың қатты денелі бөлшектің өлшемдерін төмендеткенде балқу температурасының ақырындап төмендейтіні байқалды. Металлдық бөлшектерде өлшемді эффект d<50 интервалда өлшемдерінде күшті байқалады.Мысалы, алтын бөлшегі ∆T=Tб.о –Тб.d температураның айырмашылығы, d<20нм (Tпл.о- макраскопиялық балқу температурасы Тб.d- жоғарғы дисперсті үлгінің балқу температурасы) байқалады.
Балқу температурасы нанодисперсті бөлшектердің размерлігіне тәуелді график (алтын)
d<5нм арақашықта балқу темперетурасы100 шақты градусқа, ал d=2нм балқу температурасысы 1000 градусқа төмендейді. Балқу температурасының төмендеуі сонымен қатар қорғасын, висмут, қалайы, индий және т.б. Металлдарда да байқалады.
Тамшыларды аса суыту
Дисперсті бөлшектердің өлшемдері тек қана балқу үдерісіне ғана емес, кристаллизация үдерісіне де күшті әсер етеді. Әртүрлі сұйықтықтардың жоғары дисперсті тамшылары аса суыту кезінде де ұзақ уақыт сұйық күйде сақталады.
Мысалы, диаметрлері 2-100 мкм болатын тамшылардың аса суытылуы (ΔTmax):
Сынап.............77 0C
Галлий............76 0C
Қорғасын.........118 0C
Күміс................227 0C
Алтын..............230 0C
Жылусыйымдылық
Өте төмен температура аумағында жылусыйымдылықтың метал нанобөлшектерінің өлшемдеріне әсері күрт байқалады. Мысалы, бұл айырмашылық палладий кластердег іатом саны азайған сайын білінеді. Макроматериалдарға қарағанда жылусыйымдылықтың нанобөлшектерде өсуі Pb,Cu,CuO да байқалады.
Нанокластерде жылусыйымдылықтың өсуінің себебі дамыған бет және оның наноқұрылымның атомдық қозғалыстағы тигізетін үлесінің өзгеруі болып табылады.
Механикалық қасиеттері
Қатты дененің механикалық қасиеттерінің бірі – беріктілігі. Материалдардың беріктілігінің сандық сипаттамасы – бір созылу кезіндегі үлгінің үзілуі жүретін шекті кернеу (Pc,Н/м2). Шекті кернеу келесі формуламен анықталады:
Pc= fc /S
Мұндағы, fc- үзілуге әкелетін созу күші; S-үлгілердің көлденең қимасының ауданы.
Яғни бөлшектің өлшемі кішірейген сайын оның беріктігі артады.
17./ Қандай электролиттер золдердің тұрақтылығына күштірек әсер етеді Иондардың Гоффмейстер лиотроптық қатарына орналасу принципін түсіндіріңіз
Бірдей зарядты иондардың коагуляциялық қабілеттіліктері шамалас болғанмен, олардың размерлері мен гидратталу көрсеткіштеріне байланысты екенін байқауға болады. Бірдей иондардың коагуляциялық кабілеттіліктері өзімізге белгілі лиотроптық қатар бойынша сипатталады.
Айта кететін бір жағдай органикалық иондардың валенттілігі өздерімен бірдей бейорганикалық иондарға қарағанда коагуляция қабілеттілігі әлдеқайда жоғары болады
Электролиттің адсорбциясы -ондағы иондардың адсорбциясы. Олардың адсорбциясы адсорбенттердің табиғатына байланысты болады. Иондар поляризацияланатын болғандықтан олар полярлы молекулалардан тұратын, иә иондардан тұратын беттерде ғана адсорбцияланады. Сондықтан иондық адсорбцияны көбінесе полярлық адсорбция деп те атайды. Беттің зарядталған микроучаскелері өзінің зарядына қарама-қарсы зарядталған иондарды адсорбциялайды. Ал адсорбцияланбаған электролиттердің иондары электростатикалық тарту күштерінің әсерінен адсорбцияланған иондардың маңында болады да, олармен бірге бірігіп адсорбент бетінде қос электрлік қабат түзеді. Иондардың адсорбциялану қабілетіне олардың радиустарының әсерлері күшті. Егер бірдей валентті иондардың адсорбциясын қарастырсақ, онда неғұрлым ионның радиусы көп болған сайын соғұрлым оның адсорбциясы күшті болады. Бұның себебі екі түрлі. Біріншіден, радиусы үлкен болса, ол ионның поляризациясы күшті, сол себепті адсорбциясы да күшті болады.
Екіншіден, егер оның ионның радиусы үлкен болса, оның гидратациясы азаяды. Ал гидратацияның иондар арасындағы адсорбцияны азайтатыны белгілі. Өйткені гидраттық қабаттар электрлік әрекеттесуді азайтады. Міне осының нәтижесінде ионның радиустары өскен сайын оның адсорбциясының да өсетіні көрініп тұр. Иондардың ортамен байланысуымен азаюына қарай орналасатын қатарды лиопроптық қатар, немесе Гоффмейстр қатары деп атайды. Бір валентті катиондар үшін оны былайша жазуға болады:
Li+< Na+< K+< Rb+< Cs+
Екі валентті катиондар: Mg2+< Ca2+< Sr2+< Ba2+
ал бір валентті аниондар төмендегіше орналасады:
Cl-< Br-< NO3-< I-< NCS-
18.\ Қандай факторлар агрегаттық және седиментациялық тұрақтылықты қамтиды Коллоидты қорғау дегеніміз не
Тұрақтылықтың негізгі екі түрі бар – седиментациялық және агрегаттық.
Агрегаттық тұрақтылық -дисперстік жүйелердің уақыт бойынша дисперстік дәрежелерін, яғни бөлшектердің өлшемін өзгертпей сақтап қалу қабілеттілігі.
Седиментациялық тұрақтылық дегеніміз – ауырлық күшіне қарсы дисперстік фазаның тұрақтылығы.Тұрақтылық факторларын кинетикалық және термодинамикалық деп бөледі.
1.Электростатикалық факторлар- беттік қабатта ҚЭҚ түзілуі нәтижесінде Липпмон теңдеуі бойынша фазааралық керілу төмендеуіне байланысты.
2.Адсорбциялық-сольваттық ф-р. Гиббс және Дюпре теңдеулеріне сәйкес дисперстік фазаның ортамен әрекеттесуі нәтижесінде фазааралық керілудің төмендеуіне байланысты.
3.Энтропиялық фактор-дисперстік фазаның көлемде таралуына байланысты.
4.Құрылым-механикалық фактор- бөлшектердің бетінде серпімділігі және механикалық беріктігі үлкен пленкалардың түзілуіне байланысты.
5.Гидродинамикалық фактор-ортаның тұтқырлығымен фазалардың тығыздығының өзгеруімен коагуляция жылдамдығын төмендетеді
6.Аралық факторлар реалды жүйелерге тән.
Лиофобтық зольдердің бөліну шекарасында еркін беттік энергия болатындықтан бет адсорбциялық қабат түзуге бейім болады. Ондай қабаттарды БАЗ немесе белоктардың молекулалары түзеді. Адсорбциялық қабат бөлшектердің барлық бетін жабуы міндетті емес. Беттің 40-60% жабылғанда жүйе тұрақтануы мүмкін. Әрина максималды тұрақтылық толық мономолекулалық қабат түзгенде болады.
Мысалы, алтынның золіне желатинді қоссақ, белок бөлшектерге адсорбцияланып, олардың сыртында қорғағыш қабыршақ түзеді. Желатиннің иондық беті бөлшектерге қосымша оң да, теріс те заряд береді. Белоктың беті су молекулаларын адсорбциялап қосымша қорғауды қамтамасыз етеді. Енді алтын зольіне қосылған натрий хлориді коллоидтық қорғау болмаған кездегіге қарағанда әлсіздеу әсер етеді. Нәтижесінде бөлшектер тұнбайды.
Р.Зигмонди «алтын саны» деген термин енгізді, ол коллоидтық қорғауды сандық түрде сипаттау үшін қажет. Жоғары дисперсті коллоидтық алтынның түсі қызыл болады, оған электролит қосқанда, алтынның дисперстілігі азайып, оның түсі көк болады.
Алтын саны деп 10 мл қызыл алтынның золінің түсін 1 мл 10 %-дық NaCI қосқанда көк түске өзгертпейтін коллоидтық қорғаудың милиграммен өрнектелген мөлшерін айтады.
Алтын саны аз болған сайын коллоидтық қорғау әсері көп болады. Әртүрлі коллоидтық қорғаулардың әсерлері де әртүрлі болады, ендеше, олардың алтын саны да әр түрлі болады.
19.\ Нанодисперсті жүйелерде қандай құрылымдар және қандай себеппен түзілуі мүмкін жауабыңызды бөлщектер әрекеттесуінің потенциалды қисықтарымен түсіндіріңіз
Дисперсті жүйелерде құрылым түзілуді дисперсті фазаның бөлшектері мен агрегаттарының кеңістіктік құрылымда бір-бірімен байланысуы деп түсінеді. Құрылым түзілу әр түрлі дисперстік жүйелерде байқалады.Дисперсиялық ортасы сұйық дисперсті жүйеде пайда болатын құрылымның түрі агрегаттық тұрақтылығымен анықталады. Құрылымдар дисперстік фаза бөлшектерінің арасындағы тартылу не тебісу күштеріне байланысты.
Егер тартылу күштері басым болса, бірінші типтегі құрылымдар түзіліп,дисперсті жүйеде фаза бөлшектерінен тұратын үшөлшемді тор(қаңқа)пайда болады. Бөлшектер арасындағы контактілердің саны мен беріктігі бөлшектер арасындағы беттік күштердің балансына тәуелді.
Егер бөлшектердің әрекеттесуі тебісу күштерімен анықталса, дисперсті фазаның белгілі концентрациясында беттік қабаттар(ҚЭҚ-тың диффузиялық бөліктері)айқасып,жүйеде екінші типтегі құрылымдар түзіледі.
Бөлшектердің әрекеттесуі мен олардың арасында байланыстардың түзілу мүмкіндігі тартылу және тебілу күштерінің тепе-теңдігімен анықталады. Дисперсті жүйелердің тұрақтылық теориясына (ДЛФО теориясына) сәйкес потенциалды қисықтар (бөлшектердің әрекеттесу энергиясының олардың арақашықтығына тәуелділігі)келесі түрде болуы мүмкін:
| Бірінші қисықта жақын энергиялық минимум U1min және потенциалды тосқауыл ΔΕ=Umax бар, тосқауылдың биіктігі >(10-15)kT.Бөлшектердің орташа кинетикалық энергиясы мұндай тосқауылдан өтуге жеткіліксіз,сонд. жүйе агрегаттық тұрақты болып келеді. Агрегатар түзілмей құрылымдар да түзілмейді. | 
|
| Екінші потенциалды қисықта энергиялық тосқауылмен Umax қатар екі минимум бар: жақын U1min және алыс U2min. Егер Umax>(10-15)kT және |U2min| >kT болса, бөлшектер арасында дисперсиялық ортаның қабаты қалып, коагуляциялық құрылымдар түзіледі. Потенциалды қисықтардың мұндай түрі үлкен бөлшектердің әрекеттесуіне тән. | 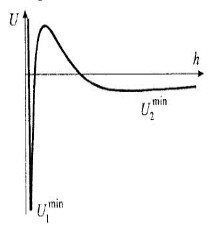
|
| Үшінші түрдегі қисықтар толығымен энергияның теріс мәндеріне сәйкес, нәтижесінде бөлшектер бір-біріне жақындап, жабысады. | 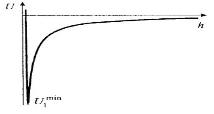
|
Ребиндердің ұсынуымен бірінші типтегі құрылымдарды коагуляциялық және конденсациялық деп бөледі.
Коагуляциялық құрылымдардың негізгі көрсеткіші- дисперстік бөлшектер бір-бірінен жұқа сұйық пленкалар арқылы бөлініп,бір-бірімен коагуляциялық не атомдық контактілер арқылы бірігеді.Беріктігі төмен.ДЛФО теориясы б/ша,жұқа сұйық пленкалар арасындағы байланыстар әлсәз молекулалық күштер арқылы түзіледі.
Конденсациялық құрылымдар фазалық контактілер арқылы түзіледі.Фазалық контактілердің ерекшелігі – олардың ауданы молекулалық өлшемдерден едәуір артық болғандықтан беріктігі жоғары болады.
Аралас құрылымдарда бірінші де, екінші де типтердің фрагменттері болады. Олар әдетте полидисперсті суспензияларда немесе бөлшектерінің табиғаты әртүрлі жүйелерде түзіледі.Мұндай жүйелерде бір түрлі бөлшектер коагуляциялық тор түзеді де,ал тордың саңылауында екінші түрдегі бөлшектер екінші типтегі құрылым түзеді.
20.\ Тиксотропия, синерезис,реопексия, реологиялық дилатансия құбылыстары қандай реологиялық жүйелерге тән. Коагуляциялық құрылымдардың ерекше қасиеті: бұзылмағаннан кейін және бұзылуға әкелген жүктемені алғаннан кейін құрылым мен оның беріктігі қайта пайда болады.бұл эффектіні тиксотропия д/а.
дисперсті фаза бөлшектері таяқша тәрізді болса коагуляциялық контактілербөлшектердің жіңішке шеттерінің арасында түзіледі. Нәтижесінде ұяшықтарында сұйық дисперсиялық орта болатын үшөлшемді құрылым(тор) түзіліп, мұндай коагуляциялық құрылымдар гель д/а.
Коагуляциялық құрылымдарға тән басқа физика-химиялық қасиетті синерезис,не коллапс д/а.синерезис д/з құрылым ұяшықтарындағы сұйық бөлініп,гельдің өлшемдерінің өздігінен кішіреюі.
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 1404; Нарушение авторских прав?; Мы поможем в написании вашей работы!