
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика химических реакций. Скорость химической реакции, константа равновесия. Условие химического равновесия
|
|
|
|
Тепловой эффект реакции. Экзотермические и эндотермические реакции. Стандартный тепловой эффект реакции. Зависимость теплового эффекта от температуры, от агрегатного состояния веществ. Закон Гесса.Адиабатическая температура горения.
Принцип работы термоэмиссионного преобразователя энергии.
Простейший ТЭП состоит из двух электродов (катода, и анода, изготовляемых из тугоплавких металлов), разделённых вакуумным промежутком (рис. 1). 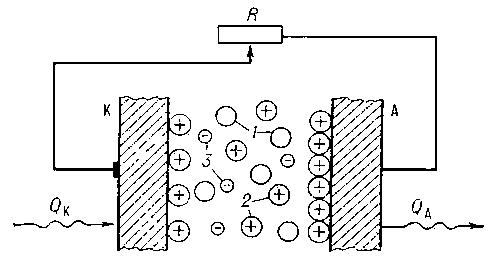
Рис. 1. Схема термоэмиссионного преобразователя:
К — катод; А — анод;
R — внешняя нагрузка; QК — тепло, подводимое к катоду; QА — тепло, отводимое от анода; 1 — атомы цезия; 2 — ионы цезия; 3 — электроны.
К катоду от источника тепла подводится тепловая энергия, достаточная для возникновения заметной термоэлектронной эмиссии с поверхности металла. Электроны, преодолевая межэлектродное пространство (несколько десятых долей мм), попадают на поверхность анода, создавая на нём избыток отрицательных зарядов и увеличивая его отрицательный потенциал. Если непрерывно обеспечивать подвод тепла к катоду и соответствующее охлаждение анода (который получает тепло от достигающих его электронов), то во внешней цепи будет поддерживаться электрический ток и таким образом совершаться работа. Так как ТЭП представляет собой по существу тепловую машину, рабочим телом которой служит «электронный газ» (электроны «испаряются» с катода — нагревателя и «конденсируются» на аноде — холодильнике), то кпд ТЭП не может превосходить кпдКарно цикла.
Тепловой эффект реакции – теплота поглощённая или выделенная в ходе протекающей реакции. Он зависит от температуры и от давления.
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.
Эндотерми́ческиереа́кции — химические реакции, сопровождающиеся поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения (Δ H > 0, Δ U > 0), таким образом, продукты реакции содержат больше энергии, чем исходные компоненты.Практически важны два типа теплового эффекта реакции - изотермо-изобарный (при постоянных температуре Т и давлении р), где d Q = dH, и изотермо-изохорный (при постоянных Т и объеме V), где dQ = dU.
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.(Ро=1бар; Т=298К=250С).
Зависимость теплового эффекта от температуры выражает закон Кирхгофа
 , если во время реакции изменяется агрегатное состояние веществ, То для переходящих веществ нужно учитывать и тепловые эффекты перехода из одного состояния в другое.
, если во время реакции изменяется агрегатное состояние веществ, То для переходящих веществ нужно учитывать и тепловые эффекты перехода из одного состояния в другое.
Закон Гесса:Тепловой эффект реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Следствие из закона: Для простых веществ (O2, O3, H2, He, Ar) тепловой эффект равен нулю.
Адиабатическая температура горения – это температура, до которой нагреваются продукты горения без теплообмена.
ΔHнизш=Спрод(Тнач – Тадиаб)
Скорость химической реакции - число протекающих реакций в единицу времени. 
Гомогенные реакции – реагенты находятся в одинаковых фазах.
Гетерогенные реакции – реакция происходит на границе раздела двух фаз.
А + B à C + D
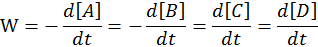
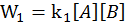 , k1 – константа скорости прямой реакции.
, k1 – константа скорости прямой реакции.
 , k1 – константа скорости обратной реакции.
, k1 – константа скорости обратной реакции.
aA +bB = cC + dD.
 k – зависит от температуры и от природы хим. вещ-тв.
k – зависит от температуры и от природы хим. вещ-тв.

W1=W2 – состояние равновесия системы.
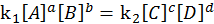
 – константа равновесия, выраженная через конц-ии.
– константа равновесия, выраженная через конц-ии.
 ;
; 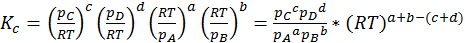
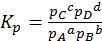 константа равновесия, выраженная через давление.
константа равновесия, выраженная через давление.

Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом.
Условием термодинамического равновесия в закрытой системе является минимальное значение соответствующего термодинамического потенциала:
Изобарно-изотермические (P = const, T = const): ΔG = 0 dG = 0, d2G > 0
Изохорно-изотермические (V = const, T = const): ΔF = 0 dF = 0, d2F > 0
43. Уравнения Гиббса – Гельмгольца – уравнения максимальной работы.
Они позволяют установить связь между максимальной работой равновесного процесса и теплотой неравновесного процесса
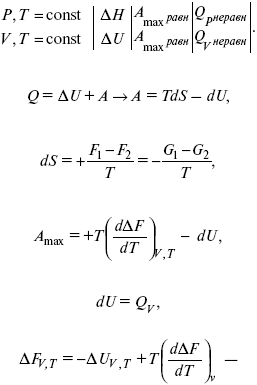
уравнение Гельмгольца (уравнение связывающее функции F и G с их температурными производными).
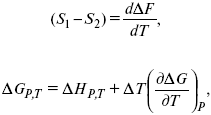
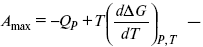
уравнение Гиббса (уравнение связывающее функции F и G с их температурными производными).
Уравнения эти дают возможность рассчитать работу через температурный коэффициент функции Гельмгольца или через температурный коэффициент функции Гиббса.
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 565; Нарушение авторских прав?; Мы поможем в написании вашей работы!