
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химический потенциал
|
|
|
|
-термодинамич. функция состояния,определяющая изменение потенциалов термодинамических при изменении числа частиц в системе и необходимая для описания свойств открытых систем (с перем. числом частиц). X. п. m i i -го компонента многокомпонентной системы равен частной производной от любого из термодинамич. потенциалов по кол-ву (числу частиц) этого компонента при пост. значениях остальных термодинамич. переменных, определяющих данный термодинамич. потенциал, напр. m i = (дF/дNi)T,V,N (F -свободная энергия, Т -темп-ра, V -объём, j 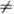 i). Т. о., в системах с перем. числом частиц в выражение для дифференциала, напр. dF, следует добавить величину
i). Т. о., в системах с перем. числом частиц в выражение для дифференциала, напр. dF, следует добавить величину 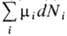 :
: 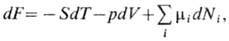 где р - давление, S -энтропия. Наиб. просто X. п. связан с термодинамич. потенциалом G (см. Гиббса энергия):
где р - давление, S -энтропия. Наиб. просто X. п. связан с термодинамич. потенциалом G (см. Гиббса энергия): 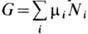 . Для однокомпонентной системы X. п. m = G/N,
. Для однокомпонентной системы X. п. m = G/N,
т. е. представляет собой энергию Гиббса, отнесённую к одной частице. Вследствие аддитивности G, кроме давления и темп-ры, X. п. зависит только от концентраций отд. компонентов, но не от числа частиц в каждом компоненте. В простейшем случае идеальных газов m i зависит только от концентрации i -го компонента:
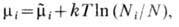 где
где 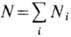 -полное число частиц, m~ i -X. п. чистого i -го
-полное число частиц, m~ i -X. п. чистого i -го
компонента.
45. Конста́нта равнове́сия
— величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 426; Нарушение авторских прав?; Мы поможем в написании вашей работы!